Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
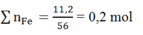
Khi ngâm m gam vào dung dịch Cu(NO3)2 thì chỉ có Fe phản ứng:
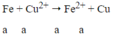
Δm = 64a - 56a = 8a → nFe = 0,4/8 = 0,05 mol
Fe3O4 → 3Fe
b 3b
Ta có: 0,05 + 2b = 0,2 → b = 0,05 mol
m = 0,05.56 + 0,05.232 = 14,4g

Đáp án B
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
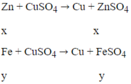
Ta có hệ:
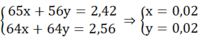
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)
![]()

Đáp án C
Ta có: ![]()
suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b
![]()
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N:
![]()
![]()
Ta có 2 TH xảy ra:
TH1: HNO3 dư.
![]()
![]()
TH2: HNO3 hết.
![]() nghiệm âm loại.
nghiệm âm loại.

Đáp án D
Khối lượng Fe = 0,3m gam và khối lượng Cu = 0,7m gam
Sau phản ứng còn 0,75m gam → Fe chỉ phản ứng 0,25m gam; Fe dư vậy sau phản ứng chỉ thu được muối Fe2+.
Ta có:
![]()
Số mol của Fe(NO3)2 = 0,25m/56
Sơ đồ phản ứng:
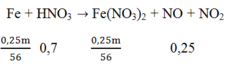
Áp dụng ĐLBT nguyên tố N ta có:
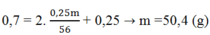

Chọn B.
Theo đề ta có: n O 2 = 1 , 225 ; n C O 2 = 1 , 05 v à n H 2 O = 1 , 05 => X no, đơn chức, mạch hở (vì n C O 2 = n H 2 O )
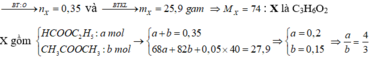

Đáp án A
Số mol Fe = 0,02 mol; số mol Cu = 0,03 mol; số mol H+ = 0,4 mol;
số mol NO3- = 0,08 mol
Các phản ứng xảy ra:
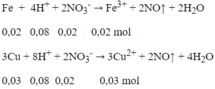
Sau 2 phản ứng trên, trong dung dịch X có 0,02 mol Fe3+; 0,03 mol Cu2+ và 0,24 mol H+ dư, ngoài ra còn có ion NO3- và SO42-. Tuy nhiên chỉ có 3 loai ion đầu là phản ứng với OH-.
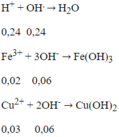
Tổng số mol OH- = 0,24 + 0,06 + 0,06 = 0,36 mol
→ V = 360ml

Chọn đáp án B
nC3H5(OH)3 = 0,2 => nNaOH = 0,06.
Bảo toàn khối lượng:
mX + mNaOH = mC3H5(OH)3 + mmuối
=> mX = 17,8.

Bài 1: Gọi số mol Mg là x, số mol Fe pư là y. số mol Fe dư là z => số mol Cu tạo thành là x + y.
Chất rắn thu được cuối cùng là MgO x mol và Fe2O3 y/2 mol
=> 24x + 56y + 56z = 1,02
64x + 64y + 56z = 1,38.
40x + 80y = 0,9
=> x = y = z = 0,0075 mol.
Vậy, trong A có mMg = 0,0075. 24 = 0,18 g. mFe = 0,0075. 2 . 56 = 0,84g. và CM CuSO4 = 0,0075.2 : 0,2 = 0,075M
Bài 2 tương tự nhé.
24x + 56y + 56z = 12,88.
2x. 108 + 2y. 108 + 56z = 48,72.
40x + 80y = 14.
=> x = 0,07. y = 0,14. z = 0,06

Đáp án D
Gọi công thức chung của hai muối cacbonat kim loại hóa trị II là RCO3
RCO3 → RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có:
mCO2 = mRCO3 - mRO = 13,4 - 6,8 = 6,6 (g)
⇒ nCO2 = 0,15 mol
Ta có: nNaOH = 0,075 mol
ð tạo ra muối NaHCO3 và CO2 dư.
⇒mmuối = 0,075.84 = 6,3(g)