Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu trả lời : D .X là 1 kim loại hoạt động yếu
Giải thích :
Nguyên tố X có hiệu số nguyên tử là 9. Điều khẳng định:
- Điện tích hạt nhân của nguyên tử là 9+, nguyên tử có 9 electron.- Nguyên tử X ở gần cuối chu kỳ 2, đầu nhóm VII.
- X là 1 phi kim hoạt động mạnh.
#Hóa học lớp 9 1

Đáp án đúng: D
Cấu hình của X: \(1s^22s^22p^5\)
+ X có số hiệu nguyên tử là 9 → Điện tích hạt nhân là 9+ và có 9e.
+ X có 7e lớp ngoài cùng và e điền vào phân lớp cuối là phân lớp p → X thuộc nhóm VIIA (gần cuối chu kì) và X có 2 lớp e → X thuộc chu kì 2.
+ X thuộc nhóm VIIA (là nhóm phi kim mạnh)

Ta có
Số proton là : p = e = z
Số neutron là n
Gọi số p, n và e ở X là z1 ; n1; e1
Tương tự như vậy vs Y ta có z2 ; n2 ;e2
Ta có:
2z1 + n1 + 2z2 + n2 = 122 (1)
Y có số n nhiều hơn X là 16 => n2 - n1 = 16 (2)
Số p ở X = 1/2 số p ở Y => 2z1 = z2 (3)
Mà số khối của X bé hơn Y là 29 => n2 - n1 + z2 - z1 =29 (4)
Thế (2) vào (4) => 16 + z2 - z1 = 29 <=> z2 - z1 = 13 . Sau đó thế tiếp vào (3) , ta có:
z1 = 13; z2 = 26
Thế z1 ; z2 vào (1) ta có:
78 + n1 + n2 = 122 <=> n1 + n2 = 44
và kết hợp với (2), áp dụng tìm 2 số khi biết tổng và hiệu, ta có:
n1 = 14; n2 = 30
Vậy X là Al ; Y là Fe
Thử lại xem KQ có khớp vs các dữ liệu của đề bài ko nha.

Những nguyên tố khí hiếm đứng cuối chu kì. Cấu hình electron của nguyên tử các nguyên tố khí hiếm có 8 electron ở lớp ngoài cùng (riêng He có 2e).

- Gọi số mol của Y là a và của Z là b mol.
- Gọi Y,Z lần lượt là nguyên tử khối của Y,Z.
- Ta có: Y-Z=8
- Mặt khác: mY=mZ=44,8/2=22,4
-Nên b>a suy ra b-a=0,05 hay b=0,05+a
-Ta có Y-Z=8 hay 22,4/a-22,4/b=8 hay 22,4/a-22,4/(a+0,05)=8
-Biến đổi ra phương trình bậc 2: a2+0,05a-0,14=0 giải ra hai nghiệm: a=0,35(nhận) và a=-0,4(loại)
- Từ đó có: a=0,35 và b=0,4 nên Y=22,4/a=22,4/0,35=64(Cu) và Z=22,4/b=22,4/0,4=56(Fe)
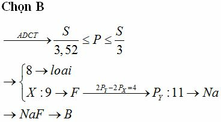

Đáp án: D