Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
a) Gọi p là số proton của nguyên tố X
Đồng vị X1 có 3 loại hạt bằng nhau nên 3p = 18 suy ra p = 6
Đồng vị X2 có tổng số hạt 20 nên 2p + n’ = 20 suy ra n’ = 8
Số khối của các đồng vị X1, X2 lần lượt là 12, 14
Phần trăm hai đồng vị bằng nhau suy ra mỗi đồng vị chiếm 50%
Atb = (12.50 + 14.50) / 100 = 13 đvC
b)
Gọi số khối của hai đồng vị X, Y là A1 và A2; phần trăm số nguyên tử của hai đồng vị này là x1 và x2. Theo giả thiết ta có:
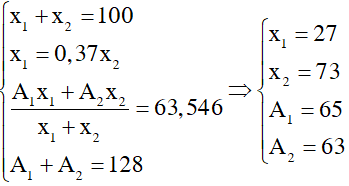
1
a , các loại hạt trong X1 bằng nhau <=> p=n1=e=6 (hạt) => A1 = 12
=> n2 = 20-6.12=8(hạt) => A2 = 8+6=14
%X1 = %X2 = 50%
\(\overline{\text{A}}=\frac{14.50+12.50}{100}=13\)
2 , gọi 2 đồng vị A1p Y và A2p Z , phần trăm của 2 đồng vị lần lượt la x1 , x2
Theo bài ra
A1 + A2 =128
x1 + x2 = 100
\(\overline{M}=\frac{A_1x_1+A_2x_2}{100}=\) 63,54
x1 - 0,37x2 = 0
=> A1 = 65 , A2 = 63

a.Số nguyên tử 115B
\(10,81=\dfrac{760.10+x11}{760+x}\)
<=> x=3240 nguyên tử

a) Gọi % số nguyên tử \(^{65}Cu\) là x
% số nguyên tử \(^{63}Cu\) là 100 - x
\(\overline{M}_{Cu}=63,546=\frac{65x+63\left(100-x\right)}{100}\)
\(\Rightarrow x=27,3\%\)
\(\Rightarrow M_{^{65}Cu}=A.x=65.27,3\%=17,745\)
\(\overline{M}_{CuO}=\overline{M_{Cu}}+\overline{M_O}=63,546+15,994=79,54\)
\(\%\left(m\right)^{65}Cu=\frac{M_{^{65}Cu}}{M_{CuO}}.100=\frac{17,745}{79,54}.100=22,31\%\)

1) có 18 công thức phân tử nước
2) 63Cu16O , 63Cu17O ,63Cu18O
65Cu16O ,65Cu17O .65Cu18O

1) Có 18 công thức phân tử nước
2) Có 6 công thức: 63Cu16O ; 63Cu17O ;63Cu18O
65Cu16O ; 65Cu17O ; 65Cu18O

4Na + O2 ------------> 2Na2O ( cần nhiệt độ )
2. Na2O + H2SO4 ------> Na2SO4 + H2O
3. Na2O + H2O -----> 2NaOH
4. Na2O + H2CO3 ------> Na2CO3 + H2O
5. 2NaOH + H2SO4 ---> Na2SO4 + 2H2O
6. Na2SO4 + Ba(OH)2 ----> BaSO4 + 2NaOH
7. Na2CO3 + Ca(OH)2 ----> 2NaOH + CaCO3
8. 2NaOH + H2CO3 ----> Na2CO3 +2H2O
9. NaOH + HCl ---> NaCl +H2O
10. Na2CO3 + BaCl2 -----> 2NaCl + BaCO3
11. Na2SO4 + BaCl2------> 2NaCl + BaSO4
bổ sung phương trình 12. từ NaCl thành Na2SO4 :
2NaCl + Ag2SO4 ---> Na2SO4 + 2AgCl

0,44-->0,22n--> 0,22
theo bài ra ta có :
0,22( 23 . 2 +nB) = 45,32
nB=160
+ với n=1 => B=160(loại)
+ n=2 => B = 80 (B là brom)
gọi số khối của đồng vị thứ nhất là B =>số khối của đồng vị thứ hai là B+2
theo bài ra ta có pt:
Số khối của đồng vị thứ hai là: 80

a) Gọi x là thành phần phần trăm của \(_{17}^{35}Cl\)
Ta có: \(\overline{A}=\frac{35x+37\left(100-x\right)}{100}=35,5\leftrightarrow x=75\)
Vậy trong tự nhiên đồng vị \(_{17}^{35}Cl\) chiếm 75% và \(_{17}^{37}Cl\) chiếm 25%
b) Ta có \(\%Cl=\frac{35,5\cdot100}{39+35,5+16\cdot4}=\frac{7100}{277}\sim25,63\%\)
\(\Rightarrow\%^{35}Cl=\frac{25,63\cdot75}{100}=\frac{7689}{400}\sim19,22\%\)

Theo đề bài ta có:
\(\left\{{}\begin{matrix}x_1=15x_2\\x_1-x_2=21x_3\end{matrix}\right.\)
<=> \(\left\{{}\begin{matrix}x_1-15x_2=0\\x_1-x_2-21x_3=0\end{matrix}\right.\)
<=> 14x2 = 21x3
<=> x3 = \(\frac{2}{3}x_2\)
Mặt khác : x1 + x2 + x3 = 100
<=> 15x2 + x2 + \(\frac{2}{3}x_2\) = 100
<=> \(\frac{50}{3}x_2\)= 100
<=> x2 = 6
<=> \(\left\{{}\begin{matrix}x_1=90\\x_3=4\end{matrix}\right.\)
Vậy .....

Đáp án D
Gọi p là số proton của X.
n1 và n2 lần lượt là số nơtron của X1 và X2