Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì nguyên tố R tạo với hidro hợp chất khí có công thức RH3
=> Oxit cao nhất của R là R2O5
Lại có trong R2O5, oxi chiếm 56,34% về khối lượng
=> \(\frac{16\times5}{2R+16\times5}\times100\%=56.34\%\)
=> R = 31
=> R là Photpho

RH4 -> RO2
%R= 53,3% => %O = 100-53,3= 46,7%
\(\dfrac{R}{53,3}\)=\(\dfrac{32}{46,7}\)
giải tìm R

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hiđro của nó là RH2, trong phân tử RH2, có 5,88% H về khối lượng
nên R có 100 - 5,88 = 94,12% về khối lượng
Trong phân tử RH2, có: 5,88% H là 2u
94,12% R là x u
Giải ra ta có x ≈ 32. Nguyên tử khối của R = 32. R là S. Công thức phân tử là SO3 và H2S.

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
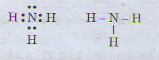

Giả sử: M số proton và nơtron lần lượt là p và n
=> Khối lượng nguyên tử của M: mp.p+mn.n
X có số p và n lần lượt là p và n
=> Khối lượng nguyên tử của X là: mp.p +mn.n
( mp và mn lần lượt là khối lượng của 1 hạt proton và 1 hạt nơtron)
Mà mp =mn = 1,67.10^-27 nên
Khối lượng nguyên tử của M: mp.( n+p)
Khối lượng nguyên tử của X : mp.(n + p )
(+++: Vì khối lượng của 1 nguyên tử là tổng khối lượng của p, e và n, mà khối lượng của e không đáng kể nên khối lượng của nguyên tử có thể tính bằng khối lượng của p và n)
* ta có:
n-p = 4 <=> n=p+4 (1)
n =p (2)
p+ xp = 58 => xp = 58 - p (3)
* Hợp chất A có công thức MX(x) trong đó M chiếm 46,67% về khối lượng nên:
M / (M+xX) = 46,67/100 <=> [mp.(n+p)] / [mp.(n+p) + x.mp.(n +p )] = 46,67/100
<=> (n+p) / [(n+p) +x(n +p )] = 46,67/100 (4)
Thay (1), (2), (3) vào (4) ta giải ra được : p = 26 => Kim loại M chính là Fe
p=26 => n= 26 +4 = 30 và xp = 32
Với x=1 => p =32 => phi kim là Ge (loại )
Với x=2 => p =16 => phi kim là S( thuộc chu kì 3 nên thỏa mãn điều kiên=> chọn)
Vậy công thức của hợp chất A là: FeS2

Gọi hợp chất khí giữa R và H là: \(H_xR\)
Theo đề bài ta có:
\(\frac{1x}{M_R}=\frac{5,88}{94,12}\)
\(\Rightarrow M_R=\frac{94,12x}{5,88}=\frac{2353x}{147}\)
Lập bảng:
| x | 1 | 2 | 3 |
| MR | 16 (loại) | 32 (nhận) | 48(loại) |
\(\Rightarrow R:S\) (Lưu huỳnh)
Ta có: \(d_{Y/H_2}=\frac{M_Y}{M_{H_2}}\Rightarrow M_Y=32.2=64\)
\(CT:S_xO_y\)
\(\Rightarrow32x+16y=64\)
\(\Leftrightarrow2x+y=2\)
\(\Leftrightarrow2x=2-y\)
...............................
\(\Leftrightarrow\frac{x}{y}=\frac{1}{2}\)
\(\rightarrow CTHH:SO_2\)

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.