
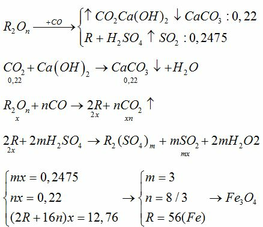
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

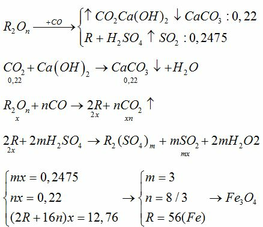

1/Gọi công thức oxit kim loại:MxOy
_Khi cho tác dụng với khí CO tạo thành khí CO2.
MxOy+yCO=>xM+yCO2
_Cho CO2 tác dụng với dd Ca(OH)2 tạo thành CaCO3:
nCaCO3=7/100=0.07(mol)=nCO2
CO2+Ca(OH)2=>CaCO3+H2O
0.07------------------>0.07(mol)
=>nO=0.07(mol)
=>mO=0.07*16=1.12(g)
=>mM=4.06-1.12=2.94(g)
_Lượng kim loại sinh ra tác dụng với dd HCl,(n là hóa trị của M)
nH2=1.176/22.4=0.0525(mol)
2M+2nHCl=>2MCln+nH2
=>nM=0.0525*2/n=0.105/n
=>M=28n
_Xét hóa trị n của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
Vậy M là sắt(Fe)
=>nFe=0.105/2=0.0525(mol)
=>nFe:nO=0.0525:0.07=3:4
Vậy công thức oxit kim loại là Fe3O4.

Gọi oxit kim loại là R2On Kim loại này phải có số oxh thay đổi
nCO=1,792/22,4=0,08 mol
R2On + nCO =>2 R + nCO2
0,08/n mol<=0,08 mol=>0,16/n mol
nH2=1,344/22,4=0,06 mol
2R +2mHCl =>2RClm +m H2
0,12/m mol<= 0,06 mol
=>m/n=4/3
Có 0,08/n(2R+16n)=4,64=>R=21n chọn n=8/3=>R=56 Fe
Oxit kim loại là Fe3O4
Gọi công thức oxit kim loại là :MxOy
_Tác dụng với CO:
nCO=1.792/22.4=0.08(mol)
MxOy+yCO=>xM+yCO2
0.08/y->0.08(mol)
=>nMxOy=0.08/y(1)
=>nO=0.08mol
=>mO=0.08*16=1.28(g)
=>mM=4.64-1.28=3.36(g)
nH2=1.344/22.4=0.06(mol)
2M+2nHCl=>2MCln+nH2
0.12/n----------------->0.06(mol)
=>M=3.36/0.12/n=28n
_Xét hóa trị của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
=>M là sắt (Fe)
=>nFe=0.12/2=0.06(mol)
=>nFexOy=0.06/x (2)
Từ(1)(2)=>
0.08/y=0.06/x
<=>0.08x=0.06y
<=>x/y=3/4
Vậy công thức oxit đầy đủ là Fe3O4

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

PTHH: \(2Fe+6H_2SO_4\left(đăc\right)\underrightarrow{t^o}Fe_2\left(SO4\right)_3+3SO_2+6H_2O\)
nFe = 5,6 / 56 = 0,1 (mol)
=> nSO2 = 0,15 (mol)
nNaOH = 0,1 x 0,1 = 0,01 (mol)
=> nOH- = 0,01 (mol)
nBa(OH)2 = 1,2 x 0,1 = 0,12 (mol)
=> nOH- = 0,24 (mol)
=> \(\sum n_{OH^-}=0,24+0,01=0,25\left(mol\right)\)
Ta có: \(1< \frac{n_{OH^-}}{n_{SO2}}< 2\)
=> Phản ứng tạo 2 muối.
Ta có phương trình ion sau:
SO22- + 2OH- ===> SO32- + H2O (1)
a...............2a
SO22- + OH- ===> HSO3- (2)
b..............b
Đặt nSO2 ở phản ứng (1), (2) lần lượt là a, b
Ta có hệ phương trình:
\(\begin{cases}a+b=0,15\\2a+b=0,25\end{cases}\)
\(\Rightarrow\begin{cases}a=0,1\\b=0,05\end{cases}\)
Lượng kết tủa là BaCO3
=> m = 0,1 x 217 = 21,7 gam

\(M_{NO}=M_{C2H6}=30\rightarrow M_{Y'}=1,35.30=40,5,y=0,04mol\)
Gọi x,y là số mol của NO,N2O trong hh ta có hệ:
\(\begin{cases}30x+44y=0,04.40,5\\x+y=0,04\end{cases}\) \(\Rightarrow n_{NO}=x=0,01,n_{N2O}=0,03\)
Gọi a,b là số mol của Fe,R trong 3,3 gam hỗn hợp:
\(Fe+HCl\rightarrow FeCl_2+H_2\)
\(R+nHCl\rightarrow RCl_n+\frac{n}{2H2}\)
\(\Rightarrow56a+Rb=3,3\) (*)
\(\Rightarrow a+\frac{bn}{2}=0,12\) (**)
Hòa tan X trong HNO3
Quá trình oxi hóa
Fe →Fe3+ +3e
R→ Rn+ +ne
Quá trình khử:
NO3- +4H+ +3e → NO +2H2O
0,04 ← 0,03 ←0,01
NO3- +8H+ +8e → N2O +2H2O
0,3 ← 0,24 ←0,03
Áp dụng bảo toàn electron ta có
3a+ nb =0,27 (3)
Từ 2,3 → a=0,03 ,nb=0,18 thay vào 1 ta có: R=9n → n=3,R=27 → là Al
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
nHNO3du =0,01.0,34=0,034 mol=nH+ dư
cho NaOH vào Z
H+ + OH- → H2O
0,034→0,034
Fe3+ + 3OH- → Fe(OH)3
0,03→0,09→0,03
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- →AlO2- + 2H2O
Vì Fe(OH)3 kết tủa hết → nAl(OH)3 =(4,77-3,21)/78=0,02 mol < nAl3+ =0,06 mol → có 2 trường hợp
TH1 : Al3+ dư → nNaOH =0,034 +0,09 +0,06 =0,184 mol → CM(NaOH)=0,184/0,4=0,46M
TH2: Al3+ hết → nNaOH =0,034 +0,09 +0,18 +0,04 =0,344 mol → CM(NaOH)=0,344/0,4=0,86M