Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 ancol đơn chức chứ bạn đáp án toàn ancol đơn chức =))
nCO2=0,4 mol nH2O=0,4 mol=>nCO2=nH2O
=>hh gồm các ete no đơn chức
Gọi CTTQ ete là CnH2nO
Bảo toàn klg=>mO2=0,4.44+7,2-7,2=17,6g=>nO2=0,55 mol
Bảo toàn O=>nete=nO trg ete=0,4.2+0,4-0,55.2=0,1 mol
=>Mete=72 g/mol
=>CTPT ete là C4H8O
Chỉ có 1 ctct tm CH2=CH-CH2-O-CH3
=>ete này đc tạo bởi 2 ancol CH3OH và CH2=CH-CH2OH
=>chọn D
Ete + O2 \(\rightarrow\)CO2 + Hoh
số mol ete là x
nCO2 = nhoh = 0.4 \(\rightarrow\) m = \(0,4.\left(18+44\right)=24,8\)
Dựa vào bảo toàn khối lượng: mO2 = 24,8 -7.2 = 17,6\(\rightarrow\) nO2 = 0,55
Bảo toàn nguyên tố oxi: x + 0,55 .2 = 0,4.3\(\rightarrow\) x = 0.1
Mete = 7,2/ 0.1 =72\(\rightarrow\) CH3 - O - C3H5
Đáp án D

Đáp án C
Pt pư:
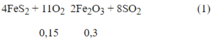
Ta có: nBaC03 = 0,15 mol
nKOH = 0,1 mol ⇒ nBa2+ = 0,15 mol ; nOH- = 0,4 mol
Khi cho SO2 vào dung dịch Y thu được 21,7 (g) BaSO3. Cho Y tác dụng với dung dịch NaOH thấy xuất hiện thêm kết tủa, chứng tỏ trong dung dịch Y có ion HSO3-.
Vì: Ba2+ + HSO3- + OH- " BaSO3 + H2O
Ta có: nBaC03 = 0,1 mol
Ptpứ:
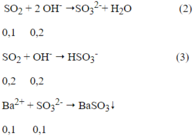
Ta có: nOH- = 0,4 - 0,2 = 0,2 mol
Theo ptpư (2), (3) ta có: n SO2= 0,1 + 0,2 = 0,3 mol
Theo ptpư (1) ta có: n FeS2 = ½ n SO2= 0,15 mol ⇒ m FeS2 = 120.0,15 = 18(g)

Đáp án A
Dựa vào bản chất phản ứng của X với NaHCO 3 , bảo toàn nguyên tố O; bảo toàn electron trong phản ứng đốt cháy X, ta có :
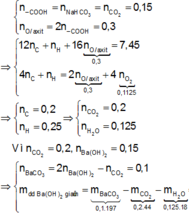
= 8,65 gam

Quy đổi hỗn hợp thành RCOOH
nRCOOH= 2nH2=0,5 mol => nOtrong axit=2nRCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 mol
CO2 + Ba(OH)2---> BaCO3+ H2O
nBa(OH)2=0,7 mol < nCO2 => Ba(OH)2 hết và CO2 dư
=> m Kết tủa = 0,7*(MBaCO3)=137,9 gam.
nCOOH= nNaHCO3=nCO2=0,5 mol => nOtrong axit=2nCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 => mCO2=44

Đáp án C
Ta có: ![]()
suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b
![]()
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N:
![]()
![]()
Ta có 2 TH xảy ra:
TH1: HNO3 dư.
![]()
![]()
TH2: HNO3 hết.
![]() nghiệm âm loại.
nghiệm âm loại.

H2=0.6 => h2so4 dư. => trong Y có 0.2 mol H2SO4.
Gọi nAl=a, nFeSO4=b. Ta có: 3a+2b=1.2 và 27a+56b=22.2
=>a=0.2, b=0.3
Dd y: fe2+: 0.3, al3+: 0.2, so4 2-: 0.8 và h- 0.4
Y td vs ba(oh)2 dư
=> kt thu đc là fe(oh)2: 0.3 mol bà baso4 0.8 mol
*lưu ý al3+ k tạo kt vì oh- dư
=> m kt=213.4g
H2=0.6 => h2so4 dư. => trong Y có 0.2 mol H2SO4.
Gọi nAl=a, nFeSO4=b. Ta có: 3a+2b=1.2 và 27a+56b=22.2
=>a=0.2, b=0.3
Dd y: fe2+: 0.3, al3+: 0.2, so4 2-: 0.8 và h- 0.4
Y td vs ba(oh)2 dư
=> kt thu đc là fe(oh)2: 0.3 mol bà baso4 0.8 mol
*lưu ý al3+ k tạo kt vì oh- dư
=> m kt=213.4g

FeSO4 -> FeO + SO2 + 1/2O2
0.01 0.01
SO2 + Ba(OH)2 -> BaSO3 + H2O
0.01 0.01
=> m= 0,72 gam.

Đáp án C
![]()
nNaOH = 0,5.0,1 = 0,05 mol
n Ba(OH)2= 0,2.0,5 = 0,1 mol
⇒nOH- = 0,1.2 + 0,05 = 0,25 mol
nBa2+= 0,1 mol
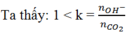
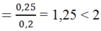
à tạo ra 2 ion CO32- và HCO3-
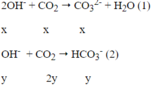
Ta có hệ phương trình:
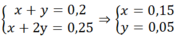
Ba2+ + CO32- " BaCO3↓
⇒mBaCO3= 0,05.197 = 9,85 g

Cho CH3CHO phản ứng với H2 (xúc tác Ni, đun nóng) thu được
A. HCOOH
B. CH3CH2OH
C. CH3COOH
D. CH3OH
Đáp án C
Dễ thấy các chất trong X đều có công thức phân tử là C x H 2 x O x .
Trong phản ứng đốt cháy, theo bảo toàn nguyên tố C và bảo toàn electron, ta có:
⇒ n O 2 = 0 , 5 V O 2 đktc = 0 , 5 . 22 , 4 = 11 , 2 lit