Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Bảo toàn điện tích → nNH4+= 0,25 mol
Khi cho 0,54 mol Ba(OH)2 vào dung dịch X xảy ra các phương trình sau:
NH4+ + OH- → NH3↑ + H2O (1)
Ba2+ + CO32- → BaCO3↓ (2)
Khối lượng dung dịch giảm = mNH3 + mBaCO3 = 0,108×17 + 0,025× 197= 6,761 gam.
Đáp án B
Chú ý trong (1) : nOH- < nNH4+ nên nNH3 = nNH4+ = 0,108 mol
Trong (2) thì nBa2+ > nCO32- → nBaCO3 = nCO32-

Áp dụng ĐLBT điện tích
0,07 - 2x - 0,1 = 0 =>x=0,015 mol
y + 2z =0,02
trộn X với Y có H+ >< OH- Ba2+ >< SO42-
dd có pH=2 => dd có mt axit => H+ dư OH- hết => \(\left[H^+\right]\)=0,01 => nH+=0,005
H+ + OH- ------> H2O
bđ y 0,1
pư 0,1 <- 0,1
spư y-0,1
=> y - 0,1 = 0,005 => y = 0,105 mol =.> z =
có sai đề k bạn

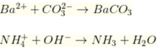
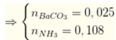
Đáp án C
Áp dụng định luật bảo toàn điện tích ta có:
Khối lượng dung dịch X giảm là do có khí NH3 thoát ra khỏi dung dịch và BaCCb kết tủa trong dung dịch sản phẩm: