Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Trong 100ml dd X có :
+ nCO32- = nCO2 = 0,1
+ Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thấy có 43 gam kết tủa
⇒ mBaCO3 + mBaSO4 = 43 ⇒ mBaSO4 = 43 – 0,1.197 = 23,3g
⇒ nSO42- = 0,1
+ nNH4+ =nNH3 = 0,2
Bảo toàn điện tích ⇒ nNa+ = 0,2
⇒ Trong 500ml ddX có mmuối =5.(0,1.60 + 0,1.96 + 0,2.18 + 0,2.23) = 119g

TN1. nKOH = 0,22 mol
2KOH + ZnSO4 → Zn(OH)2 + K2SO4 (1)
2KOH + Zn(OH)2 → K2ZnO2 + 2H2O (2)
Gọi x là số mol của Zn(OH)2 phản ứng ở pt (2)
ð Số mol của Zn(OH)2 tạo ra ở pt (1) là \(x+\frac{3a}{99}\); nKOH = 2x + \(2\left(x+\frac{3a}{99}\right)\)= 0,22 mol (1')
TN2. nKOH = 0,28 ; Lượng KOH ở thí nghiệm 2 lớn hơn TN1 là 0,28 – 0,22 = 0,06 mol.
Tương tự như trên ta có: nKOH = (2x + 0,06) + \(2\left(x+0,03+\frac{2a}{99}\right)\)= 0,28 mol (2')
Từ (1') và (2') => x = 0,01 ; a = 2,97 ==> nZnSO4 = = 0,1 mol => mZnSO4 = 161.0,1 = 16,1g

Gọi số mol mỗi ion NH4+, K+, CO32-, SO42- trong mỗi phần lần lượt là x, y, z , t mol
Phần 1: Ba2++ CO32-→ BaCO3
z z
Ba2++ SO42- → BaSO4
t t
NH4++ OH-→ NH3+ H2O
x x = 0,3 mol
mkết tủa= mBaCO3+ mBaSO4= 197z+233t= 43 suy ra t= 0,1 mol
Phần 2: 2H++ CO32- → CO2+ H2O
z mol z mol= 0,1
Định luật bảo toàn điện tích: x+y=2z+ 2t suy ra y= 0,1 mol
mmuối= (18x+ 39y+60z+96t).2= 49,8 gam

Chọn đáp án A
Chú ý tỉ lệ dung dich X trong mỗi phản ứng
Gọi số mol ion Na+, NH4+, CO32- và SO42- trong 100ml lần lượt a, b, c, d mol
Khi cho X tác dụng với HCl chỉ có CO32- tham gia phản ứng → c = 0,1 mol
Khi cho X tác dụng với BaCl2 thu được BaCO3 và BaSO4 → 0,1.197 + d.233= 43 → d = 0,1 mol
Khi cho X tác dụng lượng dư dung dịch NaOH chỉ có NH4+ tham gia phản ứng → b = 0,2 mol
Bảo toàn điện tích trong dung dịch X → a = 2. 0,1 + 2. 0,1 -0,2 = 0,2 mol
Vậy trong 300ml dung dịch X gồm 0,6 mol Na+, 0,6 mol NH4+, 0,3 mol CO32- và 0,3 mol SO42-
→ m = 0,6.23 + 0,6. 18 + 0,3. 60 + 0,3. 96= 71,4 gam.
Đáp án A.

Chọn A
Gọi số mol Na + , NH 4 + , CO 3 2 - và SO 4 2 - trong 100ml dung dịch X lần lượt là x, y, z và t.
Bảo toàn điện tích có: x + y – 2z – 2t = 0 (1)
Cho 100ml X tác dụng với HCl dư:
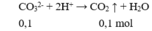
→ z = 0,1 (2)
Cho 100ml X tác dụng với BaCl2 dư:
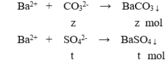
m↓ = 43 (gam) → 197z + 233t = 43 (3)
Cho 100 ml X tác dụng với NaOH
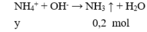
→ y = 0,2 (4)
Từ (1); (2); (3); (4) có x = y = 0,2; z = 0,1; t = 0,1.
Tổng khối lượng muối trong 300ml dung dịch là:
m = 3. (0,2.23 + 0,2.18 + 0,1.60 + 0,1.96) = 71,4 gam.


Ta tính toán số liệu với 100 ml dung dịch X.
Đáp án D