Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

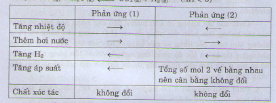
với yếu tố nhiệt độ thì giảm nhiệt độ vì đây là phản ứng tỏa nhiệt vì giảm nhiệt độ phản ưng chuyển dịch theo chiều tỏa nhiệt
với áp suất : tăng áp suất vì vế trái có 4 phân tử khí vế phải có 2 phân tử khí khi tăng áp suất là chuyển dịch theo chiều giảm số phân tử khí
tăng nồng độ N2 hoặc H2 hoặc tăng cả hai vì khi làm như vậy tốc độ phản ứng sẽ xảy ra theo chiều làmtăng nộng độ chất đó

=
= 0, 025 mol
Phương trình hóa học của phản ứng:
NaBr + AgNO3 → AgBr↓ + NaNO3
X mol x mol x mol
NaCl + AgNO3 → AgCl↓ + NaNO3
Y mol y mol y mol
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dung dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
Ta có hệ phương trình đại số:
Giải ra , ta có x = 0, 009 mol NaBr
→ mNaBr = mNaCl = 103 x 0,009 = 0,927g
C% = x 100% = 1,86%

Các yếu tố ảnh hưởng đến tốc độ phản ứng:
a) Ảnh hưởng của nồng độ.
Khi nồng độ chất phản ứng tăn, tốc độ phản ứng tăng.
Giải thích:
- Điều kiên để các chất phản ứng được với nhau là chúng phải va chạm vào nhau, tần số va chạm càng lớn thì tốc độ phản ứng càng lớn.
- Khi nồng độ các chất phản ứng tăng, tần số va chạm tăng nên tốc độ phản ứng tăng. Tuy nhiên không phải mọi va chạm đều gây ra phản ứng tăng. Tuy nhiên không phải mọi va chạm đều gây ra phản ứng, chỉ có những va chạm có hiệu quả mới xảy ra phản ứng. Tỉ số giữa số va chạm có hiệu quả và số va chạm chung phụ thuộc vào bản chất của các chất phản ứng, nên các phản ứng khác nhau có tốc độ phản ứng không giồng nhau.
b) Ảnh hướng của áp suất.
Đối với phản ứng có chất khí tham gia, khi áp suất tăng, tốc độ phản ứng tăng.
Giải thích: Khi áp suất tăng, nồng độ chất khí tăng theo, tần số va chạm tăng nên tốc độ phản ứng tăng.
c) Ảnh hưởng của nhiệt độ.
Khi nhiệt độ tăng, tốc độ phản ứng tăng.
Giải thích: Khi nhiệt độ tăng dẫn đến hai hệ quả sau:
- Tốc độ chuyển động của các phần tử tăng, dẫn đến tần số va chạm giữa các chất phản ứng tăng.
- Tần số va chạm có hiệu quả giữa các chất phản ứng tăng nhanh. Đây là yếu tố chính làm cho tốc độ phản ứng tăng nhanh khi tăng nhiệt độ.
d) Ảnh hưởng của diện tích bề mặt.
Đối với phản ứng có chất rắn tham gia, khi diện tích bề mặt tăng, tốc độ phản ứng tăng.
Giải thích: chất rắn với kích thước hạt nhỏ có tổng diện tích bề mặt tiếp xúc với chất phản ứng lớn hơn so với chất rắn có kích thước hạt lớn hơn cùng khối lượng, nên có tốc độ phản ứng lớn hơn.
e) Ảnh hưởng của chất xúc tác.
Chất xúc tác làm tăng tốc độ phản ứng, nhưng không bị tiêu hao trong phản ứng.
Giải thích: người ta cho rằng sự hấp thụ các phana tử phản ứng trên bề mặt chất xúc tác làm tăng hoạt tính của chúng. Chất xúc tác làm yếu liên kiết giữa các nguyên tử của phân tử tham gia phản ứng làm biến đổi cơ chế phản ứng nên làm tăng tốc độ phản ứng.

Những cặp chất xảy ra phản ứng oxi hoá - khử :
(1)
(2) MnO2 + 4HCl > MnCl2 + Cl2 + 2H2O
b) Trong phản ứng (1) :
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hoá nguyên tử hiđro.
- Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2) :
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl được gọi là sự oxi hoá ion clo.
- Ion Mn nhận electron là chất oxi hoá. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.
Đáp án A
Chất xúc tác không làm ảnh hưởng đến chuyển dịch cân bằng. Loại C, D
Tổng số mol khí trước và sau phản ứng là không đổi nên áp suất không ảnh hưởng đến CB chuyển dịch
Chọn A