Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 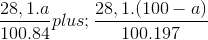 = 0,2
= 0,2
=> a = 29,89.

a) Số mol canxi cacbonat tham gia phản ứng
=
= 0,1 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Theo phương trình hóa học, ta có:
=
= 0,1 mol
Khối lượng của canxi clotua tham gia phản ứng:
= 0,1 . (40 + 71) = 11,1 g
b) Số mol canxi cacbonat tham gia phản ứng:
=
= 0,05 mol
Theo phương trình hóa học, ta có:
=
= 0,05 mol
Thể tích khí CO2 ở điều kiện phòng là:
= 24 . 0,05 = 1,2 lít

Để điều chế phân đạm NH4NO3 cần phải có NH3 và HNO3.
Từ không khí, than, nước, có thể lập sơ đồ điều chế phân đạm NH4NO3 như sau:
 → NO → NO2 → HNO3 → NH4NO3
→ NO → NO2 → HNO3 → NH4NO3
C + O2 → CO2: cung cấp nhiệt cho các phản ứng.
Có thể tính như sau: Trong 310 gam Ca3(PO4)2(3CaO.P2O5) có chứa x gam P2O5.
Từ đó ta tính được khối lượng P2O5: x = 142 x (35 : 310) = 16 (g)
Hàm lượng P2O5 là 6%

TH1: Cả 2 muối \(NaX\) và \(NaY\) đều pứ vs \(\text{AgNO3}\)
\(NaZ\) + \(AgNO_3\) \(\rightarrow\) \(NaNO_3\) + \(AgZ\)
TH2: 2 muối của X và Y lần lượt là \(NaF\) và \(NaCl\)
Mol \(AgCl\) =8,61/143,5 = 0,06mol
0,06<= 0,06
m\(NaCl\) = 0,06.58,5=3,51g
%m\(NaF\) = 2,52/6,03 .100% = 41,79%
Do AgF tan, khác các muối còn lại nên chia thành 2 trường hợp:
TH1: Hai muối ban đầu là NaF và NaCl —> nNaCl = nAgCl = 0,06 —> %NaF = 41,79%
TH2: Cả 2 muối đều tạo kết tủa:
m tăng = n muối (108 – 23) = 8,61 – 6,03 —> n muối = 0,03 —> M = 198,6 —> Halogen = M – 23 = 175,6: Vô nghiệm

Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: = 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
a) nFe = 2,8 / 56 = 0,05 mo
l Phương trình hoá học:
Fe + 2HCl -----> FeCl2 + H2
0, 05 mol 2.0,05 mol 0,05 mol
Theo phương trình trên ta có
nFe = nH = 0,05 VH2= 0,05 x 22,4 = 1,12 l.
b) nHCl = 2nFe = 2 x 0,05 = 0,1 mol
mHCl cần dùng: 0,1 x 36,5 = 3,65 g.

a) Khối lượng TNT thu được.
b) Khối lượng axit HNO3 đã phản ứng.
Hướng dẫn.
- HS viết pthh ở dạng CTPT.
- Tìm mối liên quan giữa chất đã biết và chất rắn cần tìm.
ĐS: Khối lượng TNT là: = 56,75 (kg).
Khối lượng HNO3 Phản ứng là: = 47,25 (kg).

m chất rắn giảm =m oxi mất đi => n [O]=0,32/16=0,02 (mol)
n CO,H2= n [O]=0,02 (mol)
=> V =0,02.22,4=0,448 lít


Đáp án D
Các trường hợp thỏa mãn: 2-4-6