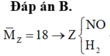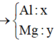Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 khí là NO và H2. Dễ tính NO = 0.1; H2 = 0.075
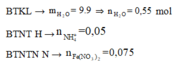
BTNT O →nZnO= 0.2
Đặt nMg = a; nAl =b.
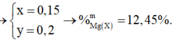
Lập hệ → %nMg = 32%
Đáp án D

Chọn đáp án D.
Khí hóa nâu ngoài không khí là NO.


Gần với giá trị 30 nhất.

Đáp án D
Khí hóa nâu ngoài không khí là NO.
![]() => Khí còn lại có phân tử khối < 18 => Khí còn lại là H2.
=> Khí còn lại có phân tử khối < 18 => Khí còn lại là H2.
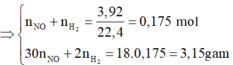
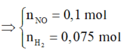
· Áp dụng bảo toàn khối lượng có:
![]()
![]()
Có:
![]()
=> Chứng tỏ có sản phẩm N H 4 + :
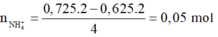
· Áp dụng bảo toàn N có: n F e ( N O 3 ) 2
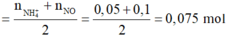
· Áp dụng bảo toàn nguyên tố O có:
![]()
![]()
· Đặt số mol của Mg, Al lần lượt là a, b
![]()
= 8,85
Vì có sản phẩm H2 tạo thành nên sau phản ứng Fe vẫn ở dạng Fe (II).
Áp dụng bảo toàn electron có:
![]()
![]()
Suy ra
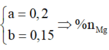
=> 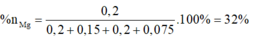
Gần với giá trị 30 nhất.

Đáp án B
Hỗn hợp khí Z là NO và H2 và
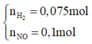
Ta có sơ đồ bài toán như sau:
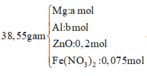


Áp dụng bảo toàn khối lượng ta có:
![]()
![]()
![]()
![]()
Áp dụng bảo toàn nguyên tố H ta có:
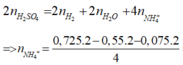
= 0,05 mol
Bảo toàn nguyên tố N:
![]()
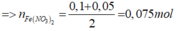
Bảo toàn nguyên tố O:
![]()
![]()
Giả sử dung dịch chỉ chứa Fe2+ áp dụng bảo toàn electron và giả sử ta có hệ sau:
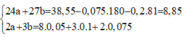
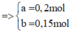

gần nhất với 30%

Cho m gam hỗn hợp X gồm ( Fe , FeO , Fe2O3 ) có tỷ lệ khối lượng tương ứng là 7:18:40 .Hỗn hợp X tan vừa hết trong 500 ml H2SO4 loãng 0,68 M thu được dung dịch B và thoát ra V lít khí H2 ( đktc). Cho dung dịch B tác dụng NaOH dư lọc kết tủa nung khô trong không khí thu được 22,4 gam chất rắn. Giá trị của V là ?
A. 0,448
B. 0,896
C. 2,24
D. 1,12