Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi X thành \(\left\{{}\begin{matrix}FeO:a\left(mol\right)\\Fe_2O_3:b\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{Fe^{2+}}=a\left(mol\right)\\n_{Fe^{3+}}=2b\left(mol\right)\end{matrix}\right.\)
=> \(\dfrac{a}{2b}=\dfrac{1}{2}\) => a = b
Phần 1: \(\left\{{}\begin{matrix}FeCl_2:0,5a\left(mol\right)\\FeCl_3:b\left(mol\right)\end{matrix}\right.\)
=> 127.0,5a + 162,5b = m1
=> m1 = 226a (g)
Phần 2: \(\left\{{}\begin{matrix}FeCl_2:0,5a\left(mol\right)\\FeCl_3:b\left(mol\right)\end{matrix}\right.\)
PTHH: 2FeCl2 + 3Cl2 --> 2FeCl3
0,5a------------->0,5a
=> 162,5(0,5a + b) = m2
=> m2 = 243,75a (g)
Mà m2 - m1 = 0,71
=> 243,75a - 226a = 0,71
=> a = 0,04 (mol)
Y chứa \(\left\{{}\begin{matrix}FeCl_2:0,04\left(mol\right)\\FeCl_3:0,08\left(mol\right)\end{matrix}\right.\)
Bảo toàn Cl: nHCl = 0,32 (mol)
=> \(V_{dd.HCl}=\dfrac{0,32}{2}=0,16\left(l\right)\)

Vì số mol FeO bằng Fe2O3.
\(FeO+Fe_2O_3\rightarrow Fe_3O_4\)
Quy đổi hỗn hợp chỉ gồm Fe3O4.
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
\(\Rightarrow n_{Fe3O4}=\frac{4,64}{56.3+16.4}=0,02\left(mol\right)\)
\(\Rightarrow n_{HCl}=8n_{Fe3O4}=0,16\left(mol\right)\)
\(\Rightarrow V_{HCl}=\frac{0,16}{1}=0,16\left(l\right)\)
Theo phản ứng: \(n_{H2O}=\frac{1}{2}n_{HCl}=0,08\left(mol\right)\)
BTKL:
\(m_{Fe3O4}+m_{HCl}=m_{muoi}+m_{H2O}\)
\(=4,64+0,16.36,5=m_{muoi}+0,08.18\)
\(\Rightarrow m_{muoi}=9,04\left(g\right)\)

Cho m gam hỗn hợp X gồm FeO, Fe2O3 , Fe3O4 vào một lượng vừa đủ d
Link tham khảo :

\(\left\{{}\begin{matrix}n_{HCl}=0,2.4=0,8\left(mol\right)\\n_{HBr}=0,2.2=0,4\left(mol\right)\end{matrix}\right.\)
=> \(n_{H_2O}=0,6\left(mol\right)\)
=> nO = 0,6 (mol)
=> mkim loại = 34,8 - 0,6.16 = 25,2 (g)
=> mmuối = 25,2 + 0,8.35,5 + 0,4.80 = 85,6 (g)

FeO + 2HCl => FeCl2 + H2O
Fe2O3 + 6HCl => 2FeCl3 + 3H2O
Quy đổi hỗn hợp chỉ gồm : FeO , Fe2O3
nFeCl2 = 7.62/127 = 0.06 (mol)
=> nFeO = nFeCl2 = 0.06 (mol)
mFeO = 0.06*72 = 4.32 (g)
mFe2O3 = 9.12 - 4.32 = 4.8 (g)
nFe2O3 = 4.8/160 = 0.03 (mol)
nFeCl3 = 2nFe2O3 = 0.06 (mol)
mFeCl3 = 0.06*162.5 = 9.75 (g)

Coi hỗn hợp X gồm : Fe , O
\(n_{Fe}=a\left(mol\right),n_O=b\left(mol\right)\)
\(m_X=56a+16b=30\left(g\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(\text{Bảo toàn e : }\)
\(3n_{Fe}=2n_O+2n_{SO_2}\)
\(\Rightarrow3a=2b+1\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.475,b=0.2125\)
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{0.475}{2}=0.2375\left(mol\right)\)
\(m_{Fe_2\left(SO_4\right)_3}=0.2375\cdot400=95\left(g\right)\)
Coi X gồm Fe(a mol) ; O(b mol)
=> 56a + 16b = 30(1)
n SO2 = 11,2/22,4 = 0,5(mol)
Bảo toàn e : 3n Fe = 2n O + 2n SO2
<=> 3a - 2b = 1(2)
Từ (1)(2) suy ra a = 0,475 ; b = 0,2125
n Fe2(SO4)3 = 0,5a = 0,2375(mol)
=> m = 0,2375.400 = 95(gam)
Thí nghiệm 2 :
Gọi n FeSO4 = y(mol) ; n Fe2(SO4)3 = x(mol)
Bảo toàn nguyên tố Fe : x + y = 0,475
Bảo toàn e : 2x.3 + 2y = 0,2125.2
=> x = -0,13125 <0
(Sai đề)

Quy đổi X thành \(\left\{{}\begin{matrix}FeO:a\left(mol\right)\\Fe_2O_3:b\left(mol\right)\end{matrix}\right.\)
Phần 1: \(\left\{{}\begin{matrix}FeCl_2:0,5a\left(mol\right)\\FeCl_3:b\left(mol\right)\end{matrix}\right.\)
=> 127.0,5a + 162,5b = 74,15
=> 63,5a + 162,5b = 74,15 (1)
Phần 2: \(\left\{{}\begin{matrix}FeCl_2:0,5a\left(mol\right)\\FeCl_3:b\left(mol\right)\end{matrix}\right.\)
PTHH: 2FeCl2 + Cl2 --> 2FeCl3
0,5a------------>0,5a
=> 162,5(0,5a + b) = 81,25
=> 0,5a + b = 0,5 (2)
(1)(2) => a = 0,4 (mol); b = 0,3 (mol)
=> m = 0,4.72 + 0,3.160 = 76,8 (g)
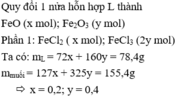

qui đổi thành Fe3O4--->n(Fe3O4)=0,06 mol
Fe3O4 +4H2SO4----->FeSO4+Fe2(SO4)3+4H2O
0,06----------------------0,06------0,06
6FeS04+3Cl2----->2FeCl3+2Fe2(SO4)3
0,06-----------------0,02-------0,02
m=0,02.162,5+(0,02+0,06).400+35,25