Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

z=16 -> 1s2 2s2 2p6 3s2 3p4 ~ Các lp phải điền đầy ~ Câu A sai vì 2p chưa điền đầy tới 6 mà đã nhảy qua 3s2

a) - 1s22s22p4 ; Số electron hóa trị là 6.
- 1s22s22p3 ; Số electron hòa trị là 5.
- 1s22s22p63s23p1 ; Số electron hòa trị là 3.
- 1s22s22p63s23p5 ; Số electron hòa trị là 7.
b)
- 1s22s22p4 ; Nguyên tố thuộc chu kì 2 nhóm VIA.
- 1s22s22p3 ; Nguyên tố thuộc chu kì 2 nhóm VA.
- 1s22s22p63s23p1 ; Nguyên tố thuộc chu kì 3 nhóm IIIA.
- 1s22s22p63s23p5 ; Nguyên tố thuộc chu kì 3 nhóm VIIA.

Cấu hình electron đầy đủ cho các nguyên tử :
a) 1s2 2s1 ;
c) 1s2 2s2 2p6 ;
e) 1s2 2p6 3s2 3p5 ;
b) 1s2 2s2 2p3 ;
d) 1s2 2s2 2p6 3s2 3p3 ;
f) 1s2 2s2 2p6 3sỗ 3p6.

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
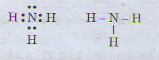

a) Nguyên tử photpho có 15e.
b) Số hiệu nguyên tử của p là : 15.
c) Lớp thứ 3 có mức năng lượng cao nhất.
d) p là phi kim vì có 5e ở lớp ngoài cùng.

HD:
X là nguyên tố Na: 1s22s22p63s1
Y là nguyên tố Cl: 1s22s22p63s23p5
Na. + Cl (7 e) ---> Na:Cl

3. Trong bảng tuần hoàn, nguyên tố X có số thứ tự 16, nguyên tố X thuộc
A. chu kì 3, nhóm IVA. C. chu kì 3, nhóm VIA.
B. chu kì 4, nhóm VIA. D. chu kì 4, nhóm IIIA.
Chọn đáp án đúng.
Bài giải:
C đúng.
Đáp án: D
R → R+ + 1e
R có cấu hình e: 1s22s22p63s23p64s1.
R có số lớp e là n = 4 → R thuộc chu kì 4.
e cuối cùng điền vào phân lớp 4s và có 1 e ngoài cùng → R thuộc nhóm IA