Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Axit sunfuric đặc có tác dụng làm khô những khí ẩm. Thí dụ làm khô khí CO2, không làm khô được khí H2S, H2 … (do có tính khử).
H2SO4 + H2 -> SO2 + H2O.
H2SO4 + H2S -> 4S + 4H2O.
b) Axit sunfuric đặc có thể biến nhiều hợp chất thành than :
C6H12O6 ![]() 6C + 6H2O.
6C + 6H2O.
C12H22O11 ![]() 12C + 11H2O.
12C + 11H2O.
c) Sự làm khô :chất được làm khô không thay đổi.
Sự hóa than : Chất tiếp xúc với H2SO4 đặc biến thành chất khác, trong đó có cacbon.
Xem thêm tại: http://loigiaihay.com/bai-4-trang-143-sgk-hoa-hoc-10-c53a9288.html#ixzz47OK5jUHW

a) khí clo
không dùng để làm khô H2S vì xảy ra p/ứ
\(2H_2SO_4+H_2S\rightarrow3SO_2+2H_2O\)

a/ Dẫn khí ẩm vào H2SO4 đặc. H2SO4 đặc sẽ hút hết hơi nước ra ngoài còn lại khí khô. Ví dụ như CO2
Một số khí bị ẩm không thể làm khô bằng H2SO4 đặc đó là NH3, CO, H2S, Cl2... do H2SO4 đặc có thể tác dụng với các chất khí này.
\(H_2SO_4\left(đ\right)+2NH_3\rightarrow\left(NH_4\right)_2SO_4\)
b/ \(C_6H_{12}O_6\rightarrow6C+6H_2O\) (xúc tác H2SO4 đặc)
\(C_{12}H_{22}O_{11}\rightarrow12C+11H_2O\) (xúc tác H2SO4 đặc)
c/ Sự làm khô :chất được làm khô không thay đổi.
Sự hóa than : Chất tiếp xúc với H2SO4 đặc biến thành chất khác, trong đó có cacbon.

Em nghĩ là D nhưng không chắc lắm, mọi người cho em ý kiến đi ![]()

Những ví dụ phương trình phản ứng hóa học của axit clohidric là phản ứng oxi hóa – khử:
Với vai trò là chất khử:
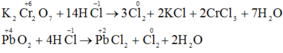
Với vai trò là chất oxi hóa :
Mg + 2HCl → MgCl2 + H2

a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 → BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
2H2SO4 + 2KBr → Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 → 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng
a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 \(\rightarrow\) BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 \(\rightarrow\) BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu \(\rightarrow\) CuSO4 + SO2 + 2H2O
2H2SO4 + S \(\rightarrow\) 3SO2 + 2H2O
2H2SO4 + 2KBr \(\rightarrow\) Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 \(\rightarrow\) 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng.

Những ví dụ phương trình phản ứng hóa học của axit clohidric là không phải là phản ứng oxi hóa – khử:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
CuO + 2HCl → CuCl2 + H2O.
Axit sunfuric đặc có thể biến nhiều hợp chất hữu cơ thành than:
C6H12O6 → 6C + 6H2O
C12H22O11 → 12C + 11H2O