Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

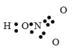
- Công thức electron:
- Công thức cấu tạo:
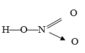
- Nguyên tố nitơ có hoá trị 4 và số oxi hoá +5

- Những tính chất khác biệt:
+ Với axit H2SO4 loãng có tính axit, còn H2SO4 đặc mới có tính oxi hoá mạnh, còn axit HNO3dù là axit đặc hay loãng đề có tính oxi hoá mạnh khi tác dụng với các chât có tính khử.
+ H2SO4 loãng không tác dụng được với các kim loại đứng sau hiđro trong dãy hoạt động hoá học như axit HNO3.
Fe +H2SO4 (loãng) → FeSO4 + H2
Cu +H2SO4 (loãng) : không có phản ứng
- Những tính chất chung:
+ Với axit H2SO4 loãng và HNO3 đều có tính axit mạnh
+ Thí dụ:
Đổi màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
2Fe(OH)2 + 3H2SO4 → Fe2(SO4)3+ 6H2O
Fe2O3 + 6HNO3 → 2Fe(HNO3)3+ 3H2O
HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2
+ Với axit H2SO4(đặc) và axit HNO3 đều có tính oxi hoá mạnh
+ Thí dụ:
Tác dụng được với hầu hết các kim loại (kể cả kim loại đứng sau hiđro trong dãy hoạt động hoá học) và đưa kim loại lên số oxi hoá cao nhất.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Cu + 2H2SO4(đặc) → CuSO4 + SO2 + 2H2O
Tác dụng với một số phi kim (đưa phi kim lên số oxi hoá cao nhất)
C + 2H2SO4(đặc) → CO2 + 2SO2 + 2H2O
S+ 2HNO3 → H2SO4 +2NO
Tác dụng với hợp chất( có tính khử)
3FeO +10HNO3 → 3Fe(NO3)3 + NO + 5H2O
2Fe(OH)2 + 4H2SO4(đặc) → Fe2(SO4)3 + SO2 + H2O
Cả hai axit khi làm đặc nguội đều làm Fe và Al bị thụ động hoá (có thể dùng bình làm bằng nhôm và sắt để đựng axit nitric và axit sunfuaric đặc)

Axit fomic có công thức cấu tạo :
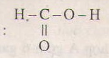
Phân tử có nhóm -CH=O, do đó, nó có tính chất của anđehit.

Hướng dẫn giải:
Ancol C5H12O
1)CH3CH2CH2CH2CH2OH
Pentan-1-ol
2) ![]()
pentan-2ol
3) 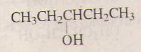
pentan-3- ol
4) 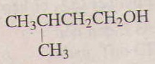
3-metylbutan-1-ol
5) 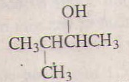
3-metylbutan-2-ol
6) 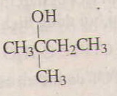
2-metylbutan-2-ol
7) 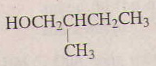
2-metylbutan-1-ol
8) 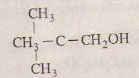
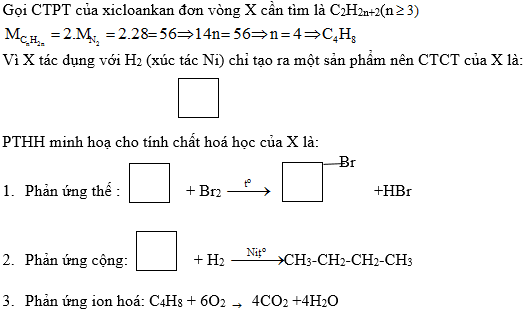
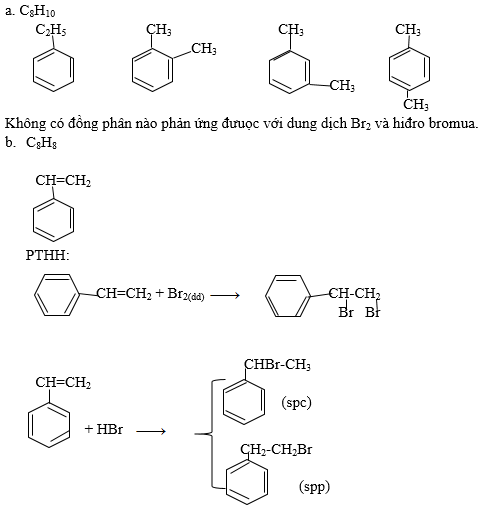
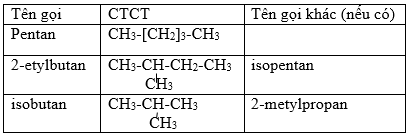
công thức electron của axit nitric
Công thức cấu tạo phân tử
Trong HNO3, nitơ có số oxi hóa +5 và hóa trị là 4