Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cl_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
2 mol 1 mol 1mol 1mol 1 mol
0,1 0,05 0,05 0,05 0,05
\(V_{NaOH}=\dfrac{0,1}{1}=0,1\left(l\right)\)
\(CM_{NaCl}=\dfrac{0,05}{0,1}=0,5M\)
\(CM_{NaClO}=\dfrac{0,05}{0,1}=0,5M\)

Ta có: \(n_{Cl_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
____0,2_______0,4______0,2______0,2 (mol)
\(\Rightarrow V_{NaOH}=\dfrac{0,4}{4}=0,1\left(l\right)\)
\(C_{M_{NaCl}}=C_{M_{NaClO}}=\dfrac{0,2}{0,1}=2\left(M\right)\)

\(n_{Cl_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
\(0.4...........0.2..........0.2.........0.2\)
\(V_{dd_{NaOH}}=\dfrac{0.4}{4}=0.1\left(l\right)\)
\(C_{M_{NaCl}}=\dfrac{0.2}{0.1}=2\left(M\right)\)
\(C_{M_{NaClO}}=\dfrac{0.2}{0.1}=2\left(M\right)\)

a) 2NaOH + Cl2 --> NaCl + NaClO + H2O
b) \(n_{Cl_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: 2NaOH + Cl2 --> NaCl + NaClO + H2O
0,1<----0,05--->0,05----->0,05
=> \(V_{ddNaOH}=\dfrac{0,1}{1}=0,1\left(l\right)\)
c)
\(\left\{{}\begin{matrix}C_{M\left(NaCl\right)}=\dfrac{0,05}{0,1}=0,5M\\C_{M\left(NaClO\right)}=\dfrac{0,05}{0,1}=0,5M\end{matrix}\right.\)

Bài 6. Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dần khí X vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Trả lời:
MnO2+4HCl→MnCl2+Cl2+2H2OnMnO2=nCl2=0,8molCl2+2NaOH→NaCl+NaClO+H2OnNaOHpu=0,5×2=1,6molnNaOHhd=0,5×4=2molnNaOHdu=2−1,6=0,4molnNaCl=nCl2=nNaClO=0,8molCNaCl=0,80,5=1,6MVNaClO=0,80,5=1,6MCNaOH=0,40,5=0,8M

a) Phương trình phản ứng: Fe + CuSO4 → FeSO4 + Cu b) Số mol của Fe là : 1,96 : 56 = 0,035 (mol) Khối lượng dd CuSO4 là : m ddCuSO4 = 1,12 . 100 = 112 (g) Khối lượng CuSO4 có trong dd là :
mCuSO4 = 10% . 112 = 11,2 (g)
Số mol của CuSO4 là :
11,2 : 160 = 0,07 mol
Fe + CuSO4 ——> FeSO4 + Cu (1)
Theo (1) ta có : nFe = nCuSO4 = 0,07 mol > 0,035 mo
l => số mol của CuSO4 dư
Vậy ta tính theo số mol của Fe.
CM CuSO4 = (0,07 – 0,035/100)*1000 = 0,35 (M)
CM FeSO4 = (0,035/100)*1000 = 0,35 (M)

\(n_{CO_2}=0,15mol\)
\(n_{NaOH}=0,35mol\)
\(T=\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{0,35}{0,15}=\dfrac{7}{3}>2\)\(\Rightarrow\) tạo muối \(Na_2CO_3\)
\(NaOH+CO_2\rightarrow Na_2CO_3+H_2O\)
0,35 0,15 0,15 0,15
\(\Rightarrow\)\(OH^-dư\) 0,2mol.
\(m_{ddsau}=0,35\cdot40+0,15\cdot44-0,15\cdot18=17,9g\)
\(C\%_{saup}\)\(_ư\)\(=\dfrac{15,9}{17,9}\cdot100=88,83\%\)

– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).

Số mol Cl2 = 1,12 : 22,4 = 0,05 mol
Phương trình hóa học:
Cl2 + 2NaOH -> NaCl + NaClO + H2O.
Phản ứng: 0,05 0,1 0,05 0,05
Dung dịch sau phản ứng có 2 chất tan là NaCl và NaClO đều có 0,05 mol; Vdd = 0,1 lít.
CM(NaCl) = CM(NaClO) =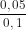 = 0,5 M
= 0,5 M
Theo đề ta có PTHH:
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
theo pt:2(mol)__________________________>: 1(mol)
Theo đề, \(n_{Cl_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo pt: \(n_{NaOH}=2n_{Cl_2}=2.0,05=0,1\left(mol\right)\)
\(\Rightarrow V_{NaOH}=0,1.1=0,1\left(M\right)\)
Có 2 chất sau phản ứng là NaCl và NaClO.
theo pt, \(n_{NaCl}=n_{Cl_2}=0,05\left(mol\right);n_{NaClO}=n_{NaCl}=0,05\left(mol\right)\)
\(\Rightarrow C_{MNaCl}=C_{MNaClO}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)