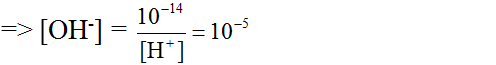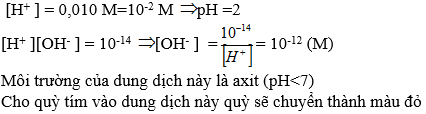K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HB
Hai Binh
17 tháng 4 2017
Đúng(0)
ND
Nguyễn Đinh Huyền Mai
18 tháng 4 2017
Đúng(0)
Các câu hỏi dưới đây có thể giống với câu hỏi trên

TN
20 tháng 7 2016
pH=9 => CH+=10-9 và COH-=10-5
Đọo pH của dung dịch có môi trường kiêm nên Phenolphtalein có màu hồng (cái này trong sách giáo khoa 11 có)

29 tháng 9 2018
pH = 9,0 ≥ [H+] = 10-9 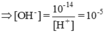
Cho phenolphtalein trong dung dịch này sẽ thấy phenolphtalein chuyển thành màu hồng (khi pH ≥ 8,3 phenolphtalein đổi màu)

28 tháng 6 2016
[H+] = 0,01M = 10-2M => pH = 2
[OH-] = 10-14 / 10-2M =10-12
Dung dịch có pH = 2 < 7 => môi trường axit, quỳ tím có màu đỏ.
BT
1
BT
1

27 tháng 12 2016
pH=1=>[H+]=10-1
pH=12=>[OH-]=10-2
ta có : H+ +OH- => H2O
10-1=>10-1
=> [OH-]ban đầu
=> a
=>