Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HD:
Câu 1.
Fe + 2HCl ---> FeCl2 + H2 (1)
FexOy + 2yHCl ---> xFeCl2y/x + yH2O (2)
Gọi a, b tương ứng là số mol của Fe và FexOy trong hh. Theo pt (1) số mol a = số mol H2 = 0,1 mol. Số mol HCl đã p.ứ ở pt (1) = 0,2 mol.
Số mol HCl ban đầu = 14,6.200/100.36,5 = 0,8 mol.
Khối lượng dd A = 200 + 17,2 - 2.1 = 215,2 g. Khối lượng dd B = 215,2 + 33 = 248,2 g.
Số mol HCl còn dư sau phản ứng = 2,92.248,2/100.36,5 = 0,19856 mol \(\approx\) 0,2 mol. Như vậy số mol HCl đã tham gia p.ứ = 0,8 - 0,2 = 0,6 mol.
Mà HCl đã p.ứ ở pt (1) là 0,2 mol nên số mol HCl đã p.ứ ở pt(2) là 0,4 mol.
Theo pt(2) số mol FexOy = 0,4/2y = 0,2/y mol. Mà khối lượng FexOy = 17,2 - 5,6 = 11,6 g. Ta có: (56x + 16y).0,2/y = 11,6. Suy ra: 56x + 16y = 58y hay x:y = 3:4
Oxit cần tìm là: Fe3O4.

Do khi phản ứng với NaOH tạo khí nên Al dư, oxit sắt hết .
Z là Fe.
2Fe+ 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
=> n Fe = 0,2 mol => n Fe (Z)= 0,8 mol
Lại có n H2 = 0,375 mol
=> nAl (Z) =0,25 mol
=> m Al2O3(Z)= 92,35 – 56.0,8 – 0,25.27 =40,8 g =>B

Đáp án A
► Đặt nZn = x; nFe = y. Do Cu2+ dư nên ta có:
– Zn + Cu2+ → Zn2+ + Cu ||⇒ tăng (65 – 64)x = x (g).
– Fe + Cu2+ → Fe2+ + Cu ||⇒ giảm (64 – 56)y = 8y (g).
Do mrắn = mkim loại ban đầu = m(g) ⇒ x = 8y.
||⇒ %mZn = 65 × 8y ÷ (65 × 8y + 56y) × 100% = 90,27%

a) Zn + S ---> ZnS; Fe + S ---> FeS;
ZnS + H2SO4 ---> ZnSO4 + H2S; FeS + H2SO4 ---> FeSO4 + H2S
b) Gọi x, y là số mol Zn và Fe: 65x + 56y = 3,72 và x + y = 1,344/22,4 = 0,06
Giải hệ: x = 0,04; y = 0,02 ---> mZn = 65.0,04 = 2,6 g; mFe = 56.0,02 = 1,12 g.
a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12


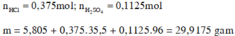
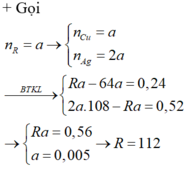
HD:
Cu + 2H2SO4 ---> CuSO4 + SO2 + 2H2O
x x
2R + 2nH2SO4 ---> R2(SO4)n + nSO2 + 2nH2O
y y/2
Zn + CuSO4 ---> ZnSO4 + Cu
x x x
nZn + R2(SO4)n ---> nZnSO4 + 2R (4)
ny/2 y/2
TH1. Nếu R là kim loại Al thì không có phản ứng (4) do đó chất rắn thu được là Cu (loại) vì khối lượng Cu sinh ra không thể = khối lượng Zn phản ứng.
TH2. Nếu R là Fe thì phản ứng (4) sẽ là: Zn + Fe2(SO4)3 ---> ZnSO4 + 2FeSO4. Do đó chất rắn thu được sau phản ứng là Cu (x mol = số mol Cu ban đầu) = khối lượng của Zn = 65 (x + y/2). Do đó: 64x = 65(x+y/2) loại. (y là số mol kim loại R ban đầu).
TH3. Nếu R là Ag thì p.ư (4) sẽ là Zn + Ag2SO4 ---> ZnSO4 + 2Ag. Chất rắn thu được sau phản ứng là Cu (x mol) và Ag (y mol). Zn đã phản ứng là x + y/2 mol.
Do đó, ta có: 64x + 108y = 65(x+y/2) hay x = 75,5y. Mặt khác: 64x + 108y = 4,94
Giải hệ thu được y = 0,001 mol. Như vậy %Ag = 0,108.100/4,94 = 2,18% (hợp lí vì đây là tạp chất nên chiếm tỉ lệ % nhỏ).
TH4. Nếu R là Au thì p.ư (4) sẽ là: 2Zn + Au2(SO4)3 ---> 3ZnSO4 + 2Au.
Ta có: 64x + 197y = 65(x+y) hay x = 132y thay vào pt: 64x + 197y = 4,94 thu được y = 0,00057 mol. Do đó %Au = 0,00057.197.100/4,94 = 2,28%.