Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

vì R có hợp chất với hidro là \(RH_4\)
\(\rightarrow\)R có hóa trị IV vậy oxit cao nhất của R với oxi là RO2
M\(_{O_2}=16.2=32\left(g\right)\Rightarrow M_{RO_2}=\dfrac{32.100}{53,3}\approx60\left(g\right)\)
\(\Rightarrow M_R=60-32=28\left(g\right)\)
vậy R là Ni(Niken)

RH4 -> RO2
%R= 53,3% => %O = 100-53,3= 46,7%
\(\dfrac{R}{53,3}\)=\(\dfrac{32}{46,7}\)
giải tìm R

Vì nguyên tố X hợp với hiđro cho hợp chất XH 4 nên nguyên tố đó thuộc nhóm IVA. Oxit cao nhất của nó sẽ là XO 2
Theo đề bài ta có : m O / m XO 2 = 53,3/100
Nguyên tử khối của oxi là 16. Gọi X là nguyên tử khối của X, ta sẽ có :
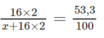
Từ đó ta có : 53,3.(x+32) = 100.32
x + 32 = 100 x 32/53,3 = 60
Nguyên tử khối của X : x = 60 - 32 = 28.
X thuộc nhóm IVA, có số khối là 28. Vậy nguyên tố đó là silic (Si)

Công thức oxit cao nhất là RO2
Có \(\dfrac{32}{M_R+32}.100\%=53,3\%=>M_R=28\left(Si\right)\)

Hợp chất khí với hidro của một nguyên tố là RH4, theo bảng tuần hoàn suy ra công thức oxit cao nhất của R là RO2, trong phân tử RO2 có 53,3% oxit về khối lượng nên R có 100% - 53,3% = 46,7% về khối lượng.
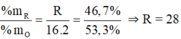
Vậy R là Si. Công thức phân tử là SiH4 và SiO2.

BT1: Công thức trong hợp chất khí với hidro : \(RH_4\)
⇒ Công thức oxit cao nhất : \(RO_2\)
% O = 53,33% ➞ % R= 100 - 53,33 = 46,67%
Ta có : \(\dfrac{\%R}{\%O}=\dfrac{M_R}{M_O}\)
⇔ \(\dfrac{46,67}{53,33}=\dfrac{M_R}{2.16}\)
⇔ \(M_R\)= 28
BT2: Công thức oxit cao nhất: R\(O_3\)
⇒ Công thức trong hợp chất khí với hidro: R\(H_2\)
%H= 5,882% ⇒ %R = 100 - 5,882 = 94,118%
Ta có : \(\dfrac{\%R}{\%H}=\dfrac{M_R}{M_H}\)
⇔ \(\dfrac{94,118}{5,882}=\dfrac{M_R}{2}\)
⇔ \(M_R\)= 32

1. Hợp chất với H là RH2 nên hợp chất oxit cao nhất là R2O6 hay RO3
Ta có :
\(\frac{16.3}{16.3+R}.100\%=36\)
\(\Rightarrow R=32\left(S\right)\)
=>R là lưu huỳnh
\(\text{SH2 %mS=32/34=94.12%}\)
2. Hóa trị trong hợp chất với H là x
-> Hóa trị trong oxit cao nhất là 8-x
\(\text{x=8-x --->x=4}\)
CT oxit cao nhất RO2
Ta có : \(\frac{32}{32+R}.100\%=53,3\%\)
\(\Rightarrow R=28\left(Si\right)\)
Hợp chất với H: \(\text{SiH4 %mSi=28/(28+4)=87.5%}\)

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hiđro của nó là RH2, trong phân tử RH2, có 5,88% H về khối lượng
nên R có 100 - 5,88 = 94,12% về khối lượng
Trong phân tử RH2, có: 5,88% H là 2u
94,12% R là x u
Giải ra ta có x ≈ 32. Nguyên tử khối của R = 32. R là S. Công thức phân tử là SO3 và H2S.

Nguyên tố X hợp với hidro cho hợp chất XH4 => Oxit cao nhất của X là XO2
Ta có : \(\frac{16\cdot2}{X+16\cdot2}\cdot100\%=53,3\%\)
\(\Rightarrow X=28\)(Silic)