Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{tăng}=57,6-56=1,6\left(g\right)=m_{Ag}\)
\(Fe+2AgNO_3->Fe\left(NO_3\right)_2+2Ag\\ \Delta m=1,6=n_{Ag}\cdot108-0,5n_{Ag}\cdot56\\ n_{Ag}=0,02\\ m_{Ag}=2,16g\)

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

a, Cứ 1 mol sắt tan trong dd thì sẽ có 1 mol Cu bám vào thanh sắt ⇒ Khối lượng tăng 8g
Vậy khi khối lượng tăng 0,8g thì nCu = nFe = 0.1 (mol)
⇒ mCu trên thanh sắt = 6,4 (g)
b, Các chất tan trong A: CuSO4; FeSO4
V = 500 ml = 0,5 (l)
nCuSO4 ban đầu = 0,5 (mol)
nCuSO4 phản ứng = 0,1 (mol)
⇒ nCuSO4 trong dd = 0,4 (mol)
⇒ CMCuSO4 = 0.8 (M)
nFeSO4 = nFe = 0,1 (mol)
⇒ CMFeSO4 = 0,2 (M)
PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
a) Gọi số mol Fe phản ứng là \(x\) \(\Rightarrow n_{Cu}=x\left(mol\right)\)
Ta có: \(64x-56x=0,8\) \(\Leftrightarrow x=0,1\)
\(\Rightarrow m_{Cu\left(bámvào\right)}=0,1\cdot64=6,4\left(g\right)\)
b) Ta có: \(n_{CuSO_4}=0,5\cdot1=0,5\left(mol\right)\)
\(\Rightarrow n_{CuSO_4\left(dư\right)}=0,5-0,1=0,4\left(mol\right)\)
Mặt khác: \(n_{FeSO_4}=0,1mol\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CuSO_4}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,5}=0,2\left(M\right)\end{matrix}\right.\)

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M

Câu 3: M giải qua rồi nên t giải tắt cho lẹ :D
Thích để phân số thì t làm phân số vậy (:
\(MnO_2\left(0,02\right)+4HCl\left(đăc\right)\rightarrow MnCl_2+Cl_2\left(0,02\right)+4H_2O\)
nMnO2 = 0,02 (MOL) => nCl2 = 0,02 (mol)
\(Fe\left(a\right)+H_2SO_4\rightarrow FeSO_4+H_2\left(a\right)\)
Gọi a là số mol Fe phản ứng
Theo đề => \(56a-2a=167,4\)
\(\Rightarrow a=3,1\left(mol\right)\)=> nH2 = 3,1 (mol)
Đun nóng hoàn toàn X thì:
\(2KClO_3-t^o->2KCl+3O_2\)
=> Chất rắn còn lại là MnO2 và KCl không bị nhiệt phân
Ta có: \(\left\{{}\begin{matrix}m_{MnO_2}=3\\m_{KCl}+m_{KClO_3}=197\\m_{MnO2}+m_{KCl}=152\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_{MnO_2}=3\left(g\right)\\m_{KCl}=149\left(g\right)\\m_{KClO_3}=48\left(g\right)\end{matrix}\right.\)
\(\Rightarrow n_{KClO_3}=\dfrac{96}{245}\left(mol\right)\)
=> \(n_{O_2}=\dfrac{144}{245}\left(mol\right)\)
* Thí nghiệm 4:
\(O_2\left(\dfrac{144}{245}\right)+2H_2\left(\dfrac{288}{245}\right)-t^o->2H_2O\left(\dfrac{288}{245}\right)\)
\(H_2\left(0,02\right)+Cl_2\left(0,02\right)-t^o->2HCl\left(0,04\right)\)
Dung dịch Y: HCl
=> nHCl = 0,04 (mol) => mHCl = 1,46 (g)
nH2O = \(\dfrac{288}{245}\) (mol) => mH2O = \(\dfrac{5184}{245}\) (g)
\(\Rightarrow C\%_{HCl}=\dfrac{1,46.100}{\dfrac{5184}{245}+1,46}=6,45\%\)
Câu 1:
A, B lần lượt là kim loại kiềm, kiềm thổ
\(2A\left(a\right)+2HCl\rightarrow2ACl+H_2\left(0,5a\right)\)\(\left(1\right)\)
\(B\left(b\right)+2HCl\rightarrow BCl_2+H_2\left(b\right)\)\(\left(2\right)\)
\(n_{HCl}=0,5\left(mol\right)\)
\(n_{H_2}=0,78\left(mol\right)\)
Gỉa sử lượng HCl tham gia phản nứng hết
=> nH2 = 1/2nHCl = 0,25 (mol) < 0,78 (mol)
=> A, B còn dư tác dụng với nước có trong dung dịch HCl
\(2A\left(1,25x-a\right)+2H_2O\rightarrow2AOH+H_2\left(0,625x-0,5a\right)\)\(\left(3\right)\)
\(B\left(x-b\right)+2H_2O\rightarrow B\left(OH\right)_2+H_2\left(x-b\right)\)\(\left(4\right)\)
Ta có: \(nA:nB=5:4\)
Gọi x là số mol của B => nA = 1,25x (mol)
\(\Rightarrow1,25xA+xB=42,6\left(I\right)\)
Gọi a, b lần lượt là số mol của A, B ở pt (1) và (2)
Ta có: \(\sum n_{H_2}=0,78=0,5a+b+0,625x+x\)
\(\Leftrightarrow x=0,48\left(mol\right)\)
Thay vào (I) \(\Leftrightarrow0,6A+0,48B=42,6\)
- Vói A = 7 (Li) => B = 80 (loại)
- Với A = 23 (Na) => B = 60 (loại)
- Với A = 39 (K) => B = 40 (Ca) thoã mãn
- A = 85 (Rb) = > B = -17,5 (loại)
- A = 133 (Cs) => B = -77,5 (loại)
- A = 223 (Fr) = > B = -290 (loại)
Vậy A: K,
B: Ca

a) Gọi kim loại cần tìm là M
\(m_{M\left(pư\right)}=\dfrac{50.1,68}{100}=0,84\left(g\right)\)
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
PTHH: 2M + 2xHCl --> 2MClx + xH2
\(\dfrac{0,03}{x}\) <--------------------0,015
=> \(M_M=\dfrac{0,84}{\dfrac{0,03}{x}}=28x\left(g/mol\right)\)
Xét x = 1 => L
Xét x = 2 => MM = 56(Fe)
b) Mình nghĩ đề thiếu dữ kiện :v

a) \(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
Gọi kim loại cần tìm là A, có hoá trị x (x:nguyên, dương)
\(2A+2xHCl\rightarrow2ACl_x+xH_2\uparrow\\ m_{giảm}=m_{kim.loại}=1,68\%.50=0,84\left(g\right)\\ n_A=\dfrac{0,015.2}{x}=\dfrac{0,03}{x}\left(mol\right)\\ \Rightarrow M_A=\dfrac{0,84}{\dfrac{0,03}{x}}=28x\left(\dfrac{g}{mol}\right)\)
Xét: x=1;x=2;x=3;x=8/3 => Nhận x=2 khi đó MA=56(g/mol)
=> A là Sắt (Fe=56)
b) Không tính được nồng độ dd muối vì không có khối lượng dung dịch HCl

a)
\(Na2CO3+2HCl\rightarrow2NaCl+H2O+CO2\left(1\right)\)
x-----------------2x-----------------------------------x
\(K2CO3+2HCl\rightarrow2KCl+H2O+CO2\left(2\right)\)
y----------2y---------------------------------------y
\(n_{CO2}=\frac{1,12}{22,4}=0,05\left(mol\right)\)
Theo bài ta có hpt
\(\left\{{}\begin{matrix}106x+138y=5,94\\x+y=0,05\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,02\\y=0,03\end{matrix}\right.\)
\(\%m_{Na2CO3}=\frac{0,02.106}{5,94}.100\%=35,69\%\)
\(\%m_{K2CO3}=100-35,69=64,31\%\)
b) Mk nghĩ ở đây phải là 300g dd HCl chứ nhỉ
\(m_{CO2}=0,05.44=2,2\left(g\right)\)
\(mdd=5,94+300-2,2=303,74\left(g\right)\)
\(m_{NaCl}=0,04.58,5=2,34\left(g\right)\)
\(C\%_{NaCl}=\frac{2,34}{303,74}.100\%=0,77\%\)
\(m_{KCl}=0,06.74,5=4,47\left(g\right)\)
\(C\%_{KCl}=\frac{4,47}{303,74}.100\%=1,47\%\)
Chúc bạn học tốt :))
Bạn xem câu trả lời của mình nha :
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu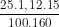 = 0,02625 mol
= 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd =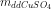 + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
+ mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 =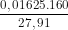 .100% ≈ 9,32%
.100% ≈ 9,32%
C%, FeSO4 =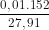 .100% ≈ 5,45%
.100% ≈ 5,45%