Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 4. Axit axetic có công thức C2H402. Hãy tính thành phần phần trăm khối lượng của các nguyên tố trong axit axetic.
Lời giải:
Từ C2H4O2 ta có: M = 60 g/mol; mC = 2 x 12 = 24 g; mH = 4 x 1 = 4 g;
MO = 2 x 16 = 32 g.
%C = (24 : 60) x 100% = 40%; %H = (4 : 60) x 100% = 6,67%;
%O = 100% - 40% - 6,67% = 53,33%.

Số mol C2H5OH = 9,2 : 46 = 0,2 (mol).
Phương trình phản ứng cháy :
C2H5OH + 3O2 -> 2CO2 + 3H2O.
0,2 0,6 0,4 mol
Thể tích khí CO2 tạo ra là : V = 0,4.22,4 = 8,96 (lít).
b) Thể tích khí oxi cần dùng là : V1 = 0,6 . 22,4 = 13,44 (lít).
Vậy thể tích không khí cần dùng là Vkhông khí = (lít).

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
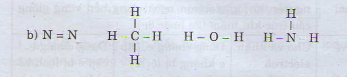
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

% C trong CH3Cl = \(\dfrac{12.100\%}{50,5}\)\(\approx\)23,76%
% H trong CH3Cl = \(\dfrac{3.100\%}{50,5}\)\(\approx\)5,94 %
% Cl trong CH3Cl = \(\dfrac{35,5.100\%}{50,5}\)\(\approx\)70,3%
% C trong C2H5OH = \(\dfrac{24.100\%}{46}\)\(\approx\)52,17%
% H trong C2H5OH = \(\dfrac{6.100\%}{46}\)\(\approx\)13,04%
% O trong C2H5OH = \(\dfrac{16.100\%}{46}\)\(\approx\)34,78%
cho mk sửa lại
% H trong C2H5OH = \(\dfrac{5.100\%}{46}\)\(\approx\)10,87%
%OH trong C2H5OH = \(\dfrac{17.100\%}{46}\)\(\approx\)36,96%


%H=\(\dfrac{2n+2}{14n+2}.100=\dfrac{100}{\dfrac{14n+2}{2n+2}}=\dfrac{100}{\dfrac{7n+1}{n+1}}\)
%H=\(\dfrac{100}{\dfrac{7n+7-6}{n+1}}=\dfrac{100}{7-\dfrac{6}{n+1}}\)
-Do 1\(\le n\) nên ta có:
+ Khi n=1 thì %H=\(\dfrac{100}{7-\dfrac{6}{1+1}}=\dfrac{100}{7-3}=25\%\)
+Khi n càng lớn thì tỉ số \(\dfrac{6}{n+1}\)giảm dần đến 0
suy ra %Hnhỏ nhất=\(\dfrac{100}{7-0}\approx14,29\%\)
-Vậy 14,29%<%H\(\le25\%\)
- 14n+2 đâu ra vậy bạn