Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nBa(OH)2=0,1.0,1=0,01 mol; nNaOH=0,1.0,1=0,01 mol
\(\rightarrow\)nOH-=2nBa(OH)2 + nNaOH=0,01.2+0,01=0,03 mol
nH2SO4=0,4.0,0375=0,015 mol ; nHCl=0,4.0,0125=0,005 mol
\(\rightarrow\) nH+=0,015.2+0,005=0,035 mol
Phản ứng: H+ + OH \(\rightarrow\) H2O
\(\rightarrow\)nH+ dư=0,035-0,03=0,005 mol
V dung dịch X=100+400=500 ml =0,5 lít
\(\rightarrow\)[H+]=\(\frac{0,005}{0,5}\)=0,01 M \(\rightarrow\) pH=-log[H+]=2

Đáp án B
nOH- = 0,1.2.0,1 + 0,1.0,1 = 0,03
nH+ = 0,4.2.0,0375 + 0,4.0,0125 = 0,035
⇒ Trong X có H+ dư
⇒ nH+/X =0,035 – 0,03 = 0,005; VX = 100 + 400 = 500ml
⇒ [H+] = 0,01 ⇒ pH = 2.

Câu 3: Gọi số mol NO là a . Có: n\(_{N_2}\) = n\(_{N_2O}\) = 2a => 5a = \(\dfrac{4,48}{22,4}\) = 0,2
=> a = 0,04 . Vậy: n\(HNO_3\) = a.4+2a.10+2a.12 = 1,92 (mol)
=> V\(_{HNO_3}\) = 1,92 (lít)

_Dung dịch HCl và HNO3 có pH=1:
=>[H+] = 10^-1 (mol/l)
=>Σ nH{+} = 10^-1*0.1 = 0.01(mol)
+nNaOH = 0.1a (mol)
NaOH => Na{+} + OH{-}
0.1a.........0.1a.......0.1a(mol)
=>nOH{-} = 0.1a (mol)
_Sau phản ứng thu được dung dịch có pH = 12:
+pH = 12:môi trường có tính bazơ => bazơ dư , axit hết.
+pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10^-2 (mol/l)
=>nOH{-} dư = 10^-2*0.2 = 2*10^-3 (mol)
H{+} + OH{-} => H2O
0.01....0.1a
0.01....0.01........0.01(mol)
..0....0.1a - 0.01.0.01(mol)
=>nOH{-} dư = 0.1a - 0.01 = 2*10^-3 (mol)
<=>0.1a = 0.012
<=>a = 0.12
Vậy a = 0.12 (M)
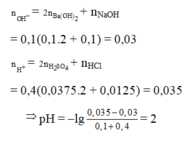
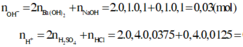
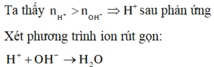
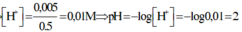
Câu 1: nOH-=0,01V(mol) nH+ =0,03V(mol)
nOH-<nH+ nên axit dư -->nH+dư =0,02V(mol)--->CM H+=0,01(M)=10-2->pH=2
Chú thích do thể tích như nhau nên ko cần đổi
Câu 2:nOH-=0,03a(mol) nH+=0,01a(mol)-->OH-dư
noh-dư=0,02a(mol) mà v=2a-->Cm oh-=0,01=10-2(M)->pH=12
Câu 3:nOH-=0,03 nH+=0,035->H+dư nH+dư=0,005 mol
V=0,5(l) CmH+=10^-2 pH=2