Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{ZnCl_2}=n_{H_2}=n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\ b,m_{ZnCl_2}=136.0,1=13,6\left(g\right);V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\\ c,Vì:\dfrac{0,1}{1}>\dfrac{0,2}{1}\Rightarrow n_{Zn\left(TT\right)}=0,1\left(mol\right);n_{Zn\left(LT\right)}=n_{ZnCl_2}=0,2\left(mol\right)\\ H=\dfrac{0,1}{0,2}.100\%=50\%\)

a) Zn + 2HCl →ZnCl2 + H2
b) nZn = 6,5/65 = 0,1 mol . Theo tỉ lệ pư => nH2 = nZn = nZnCl2 =0,1 mol <=> VH2(đktc) = 0,1.22,4 = 2,24 lít.
c) mZnCl2 = 0,1 . 136 = 13,6 gam
d) nHCl =2nZn = 0,2 mol => mHCl = 0,2.36,5= 7,3 gam
Cách 2: áp dụng định luật BTKL => mHCl = mZnCl2 + mH2 - mZn
<=> mHCl = 13,6 + 0,1.2 - 6,5 = 7,3 gam

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{4,8}{65}=\dfrac{24}{325}\left(mol\right)\)
Đến đây thì ra số mol hơi xấu, bạn xem lại đề nhé.

Zn+2HCl->ZnCl2+H2
0,2-----0,4---0,2----0,2
nZn=0,2 mol
=>m Hcl=0,4.36,5=14,6g
m muối=0,2.136=27,2g
=>VH2=0,2.22,4=4,48l
`Zn + 2HCl -> ZnCl_2 + H_2` `\uparrow`
`n_(Zn) = 13/65 = 0,2 mol`.
`n_(HCl) = 0,4 mol`.
`m_(HCl) = 0,4 xx 36,5 = 14,6g`.
c, `m_(ZnCl_2) = 0,2 xx 127 = 25,4 g`.
`d, V_(H_2) = 0,2 xx 22,4 = 4,48l`.

a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0,1
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\\
V_{H_2}=0,1.22,4=2,24l\\
m_{\text{dd}}=6,5+200-\left(0,1.2\right)=206,3g\)
bài 2 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{HCl}=0,4.36,5=14,6g\\
V_{H_2}=0,2.22,4=4,48l\\
m\text{dd}=4,8+200-0,4=204,4g\\
C\%=\dfrac{0,2.136}{204,4}.100\%=13,3\%\)
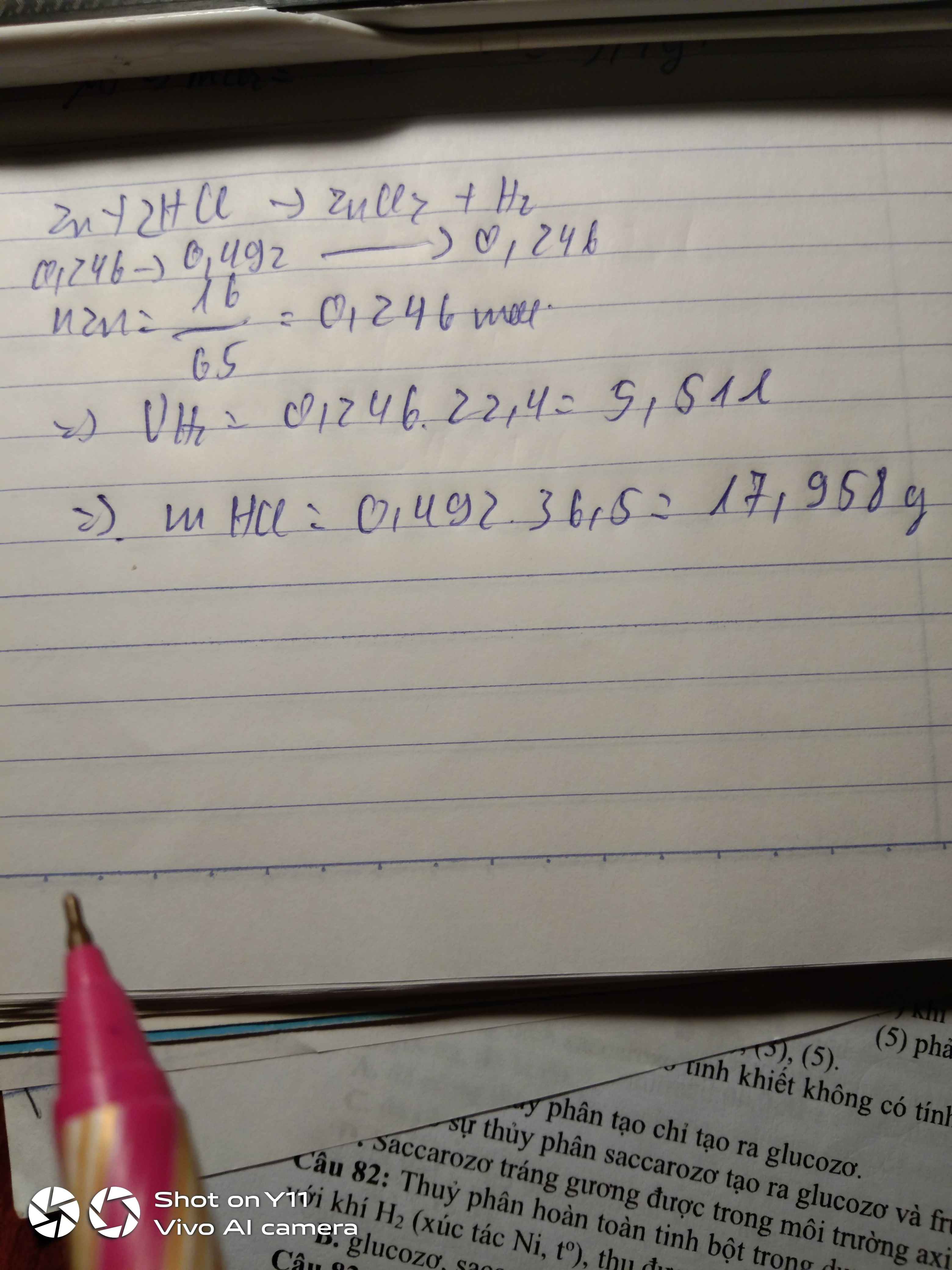
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,1 0,1 ( mol )
\(V_{H_2}=0,1.22,4=2,24l\)
\(m_{ZnCl_2}=0,1.136=13,6g\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0.1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{ZnCl_2}=0,1\cdot135=13,5g\)