Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\n_{H_2SO_4}=0,4\cdot1=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{ZnSO_4}=0,3\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{ZnSO_4}}=\dfrac{0,3}{0,4}=0,75\left(M\right)\\C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,1}{0,4}=0,25\left(M\right)\end{matrix}\right.\)

Chọn D
Gọi số mol của FeO và CuO lần lượt là x và y mol
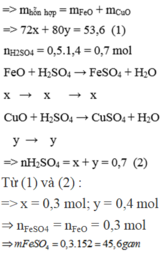
Ta có: m d d H 2 S O 4 = D . V = 1 , 2 . 500 = 600 g a m
Vì phản ứng không tạo ra chất khí hay kết tủa nên:
m d d s a u p ư = m t r ư ớ c p ư = m h h A + m d d a x i t = 53 , 6 + 600 = 653 , 6 g a m .
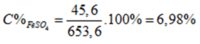

nCuSO4 =16/160 = 0,1(mol) ; nNaOH = 12/40 = 0,3 (mol)
a) PTHH
CuSO4 + 2NaOH -------> Cu(OH)2 + Na2SO4
b)
PTHH:
_________CuSO4 + 2NaOH -------> Cu(OH)2 + Na2SO4
ban đầu: 0,1-------->0,3
phản ứng: 0,1-------->0,2------------->0,1--------...
kết thúc: 0----------->0,1--------------->0,1_____...
Sau phản ứng khối lượng chất rắn thu được là:
mCu(OH)2 = 0,1*98 = 9,8 (g)
c)
Khi cho 40ml dung dịch có chứa 16g CuSO4 với 60 ml dung dịch có chứa 12g NaOH thì thể tích sau khi pản ứng là:
V = 60 + 40 = 100 (ml) = 1 (l)
Sau phản ứng thu được:
0,1 mol Na2SO4 và 0,1 mol NaOH (dư)
Vậy nồng độ của Na2SO4 và NaOH sau phản ứng lần lượt là
CM(Na2SO4) = n/V = 0,1/0,1=1 (M)
CM(NaOH) = n/V = 0,1/0,1 = 1 (M).
cho 8g fe2o3 phản ứng hoàn toàn với dung dịch HCl 1M . Viết phương trình hóa hôc của phản ứng trên . Tính thể tích dung dịch HCl 1M cần dùng .Tính nồng độ phần trăm của chất có trong dung dịch sau phản ứng biết rằng thể tích thay đổi không đáng kể
Gỉai dùm bài này đi ạ e thi mà e ko biết đúng

Gọi công thức tổng quát oxit đó là A2O3
A2O3+6HNO3->2A(NO3)3+3H2O
nHNO3=2.4(mol)
nA2O3=0.4(mol)
MA2O3=64:0.4=160(g/mol)
MA=(160-48):2=56(g/mol)
->Kim loại đó là Fe
CTHH của oxit đó là Fe2O3
nFe(NO3)3=0.8(mol)
CM=0.8:0.8=1(M)

a) PTHH: CuO + H2SO4 → CuSO4 + H2O (1)
b) \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
Theo PT1: \(n_{H_2SO_4}=n_{CuO}=0,2\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,2\times98=19,6\left(g\right)\)
\(\Rightarrow C\%_{ddH_2SO_4}=\dfrac{19,6}{400}\times100\%=4,9\%\)
c) Theo PT1: \(n_{CuSO_4}=n_{CuO}=0,2\left(mol\right)\)
\(\Rightarrow m_{CuSO_4}=0,2\times160=32\left(g\right)\)
\(\Sigma m_{dd}=16+400=416\left(g\right)\)
\(\Rightarrow C\%_{ddCuSO_4}=\dfrac{32}{416}\times100\%=7,69\%\)
d) CuSO4 + BaCl2 → BaSO4↓ + CuCl2 (2)
Theo PT2: \(n_{BaSO_4}=n_{CuSO_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,2\times233=46,6\left(g\right)\)
Vậy m=46,6

\(n_{CuO}=\dfrac{8}{80}=0.1\left(mol\right)\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(0.1...........0.1.........0.1\)
\(n_{NaOH}=0.24\cdot0.5=0.12\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(0.12..........0.06\)
\(n_{H_2SO_4}=0.1+0.06=0.16\left(mol\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.16}{1}=0.16\left(l\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.06}{0.16}=0.375\left(M\right)\)
\(C_{M_{CuSO_4}}=\dfrac{0.1}{0.16}=0.625\left(M\right)\)
a) PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
Hiện tượng: Chất bột tan dần, dd chuyển màu xanh
b+c) Ta có: \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=0,4\left(mol\right)\\n_{CuCl_2}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{ddHCl}=\dfrac{0,4}{2}=0,2\left(l\right)\\C_{M_{CuCl_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\end{matrix}\right.\)
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{16}{80}=0,2\left(mol\right)\)
a) Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,2 0,2 0,2
Hiện tượng quan sát được : CuO bị hòa tan trong dung dịch H2SO4 tạo ra dung dịch có màu xanh lam
b) Số mol của dung dịch axit sunfuric
nH2SO4 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Thể tích của dung dịch axit sunfuric cần dùng
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,2}{2}=0,1\left(l\right)\)
c) Số mol cuả muối đồng (II) sunfat
nCuSO4 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Nồng độ mol của của muối đồng (II) sunfat
CM = \(\dfrac{n}{V}=\dfrac{0,2}{0,1}=2\left(M\right)\)
Chúc bạn học tốt