Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) đúng.
b) sai, đinh sắt đặt trong không khí ẩm mới bị ăn mòn
c) đúng
d) đúng

PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
chúc bạn học tốt và nhớ tích đúng cho mình

Khối lượng thanh sắt tăng 28,8 - 28 = 0,8 gam
PTHH: Fe + CuSO4 ===> FeSO4 + Cu
56 g__ 1 mol_____________64 gam ____ tăng 64 - 56 = 8 gam
5,6 g__0,1 mol____________6,4 gam ____ tăng 6,4 - 5,6 = 0,8 ga,
CM(CuSO4) = 0,1 / 0,25 = 0,4M

Khối lượng thanh sắt tăng: 28,8-28=0,8 g
PT:
Fe + CuSO4 ---> FeSO4 + Cu
56g---1 mol----------------------64g----tăng 64-56=8 g
5,6g---0,1 mol-------------------6,4g---tăng 0,8 g
Nồng độ CM của dd CuSO4:
CM =0,1/0,25=0,4 m

Fe+CuSO4->FeSO4+Cu
Khối lượng tăng của thanh kim loại=m Cu sinh ra-mFe phản ứng=28.8-28=0.8(g)
Gọi nFe phản ứng là x(mol)->nCu=x(mol)
->64x-56x=0.8
x=0.1(mol)
->CM dd CuSO4=0.1:0.25=0.4(M)

nCuSO4 = \(\frac{50.1,12.15\%}{160}=0,0525mol\)
Fe + CuSO4 => FeSO4 + Cu
0,02-->0,02------->0,02---->0,02
nFe pư= \(\frac{5,16-5}{64-56}=0,02mol\)
mdd = 5+50.1,12 - 0,02.64 = 59,72 (g)
C% CuSO4 = \(\frac{\left(0,0525-0,02\right).160}{59,72}.100\%=8,7\%\)
C% FeSO4 = \(\frac{0,02.152}{59,72}.100\%=5,09\%\)

Gọi a là số mol C u S O 4 tham gia phản ứng
Phương trình hóa học:
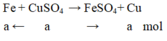
Theo đề bài ta có: m C u b á m v à o – m F e tan r a = m K L t ă n g
64a – 56a = 0,8 ⇒ a = 0,01 mol
Nồng độ dung dịch C u S O 4 là: C M = n V = 0,01 0,2 = 0,5 M
⇒ Chọn C.
A. sau khi dùng, rửa sạch, lau khô.
Câu A đúng.