Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nAl = nZn = a (mol)
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a---------------------->1,5a
Zn + 2HCl --> ZnCl2 + H2
a--------------------->a
=> 1,5a + a = 0,6
=> a = 0,24 (mol)
=> mhh = 0,24.27 + 0,24.65 = 22,08 (g)
Gọi \(n_{Al}=n_{Zn}=a\left(mol\right)\)
PTHH:
2Al + 6HCl ---> 2AlCl3 + 3H2
a a
Zn + 2HCl ---> ZnCl2 + H2
a a
\(\rightarrow22,4\left(a+a\right)=13,44\\ \Leftrightarrow a=0,3\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Al}=0,3.27=8,1\left(g\right)\\m_{Zn}=0,3.65=19,5\left(g\right)\end{matrix}\right.\\ \rightarrow m_{hh}=8,1+19,5=27,6\left(g\right)\)

Đặt nAl = a (mol)
Vì theo đề: nAl = nZn
=> nZn = a (mol)
PT: 2Al + 6HCl -----> 2AlCl3 + 3H2\(\uparrow\)
Zn + 2HCl -----> ZnCl2 + H2\(\uparrow\)
Mà VH2 thu được = 13,44 (l)
hay : \(\left(\dfrac{3a}{2}+a\right).22,4=13,44\Rightarrow a=0,24\)
Thay a = 0,24 vào hai PTHH, ta được
+) nHCl đã dùng (TT) = \(\left(\dfrac{0,24.6}{2}+\dfrac{0,24.2}{1}\right).\dfrac{100}{80}=1,5\left(mol\right)\)
=> mHCl đã dùng (TT) = 1,5 . 36,5 = 54,75(g)
+) mkim loại đã dùng = \(\dfrac{0,24.27.100}{80}+\dfrac{0,24.65.100}{80}=27,6\left(g\right)\)

2Al+6HCl->2AlCl3+3H2
x-----------------x---------\(\dfrac{3}{2}\)x
Zn+2HCl->ZnCl2+H2
y---------------y--------y
Ta có :
\(\left\{{}\begin{matrix}27x+65y=24,9\\\dfrac{3}{2}x+y=0,6\end{matrix}\right.\)
=>x=0,2 mol ,y=0,3 mol
=>m AlCl3= 0,2.133,5=26,7g
=>m ZnCl2 =0,3.136=40,8g
=>%mAl=\(\dfrac{0,2.27}{24,9}.100\)=21,69%
=>%m Zn=78,31%

Câu 2 :
\(n_{Cu}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(m=64a+27b=11.8\left(g\right)\left(1\right)\)
\(BTKL:m_{O_2}=18.2-11.8=6.4\left(g\right)\)
\(n_{O_2}=\dfrac{6.4}{32}=0.2\left(mol\right)\)
\(2Cu+O_2\underrightarrow{^{^{t^0}}}2CuO\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
\(n_{O_2}=0.5a+0.75b=0.2\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.2\)
\(\%Cu=\dfrac{0.1\cdot64}{11.8}\cdot100\%=54.23\%\)

\(n_{Zn} = a(mol) ; n_{Al} = b(mol) ; n_{Mg} = c(mol)\\ \Rightarrow 65a + 27b + 24c = 44,1(1)\\ Zn + 2HCl \to ZnCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3 H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + 1,5b + c = \dfrac{31,36}{22,4} = 1,4(2)\\ Mà : 2a = 3b(3)\\ (1)(2)(3) \Rightarrow a = 0,3 ; b = 0,2 ; c = 0,8\\ \%m_{Zn} = \dfrac{0,3.65}{44,1}.100\% = 44,22\%\\ \%m_{Al} = \dfrac{0,2.27}{44,1}.100\% = 12,24\%\)
\(\%m_{Mg} = 100\% -44,22\% -12,24\% = 43,54\%\)

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

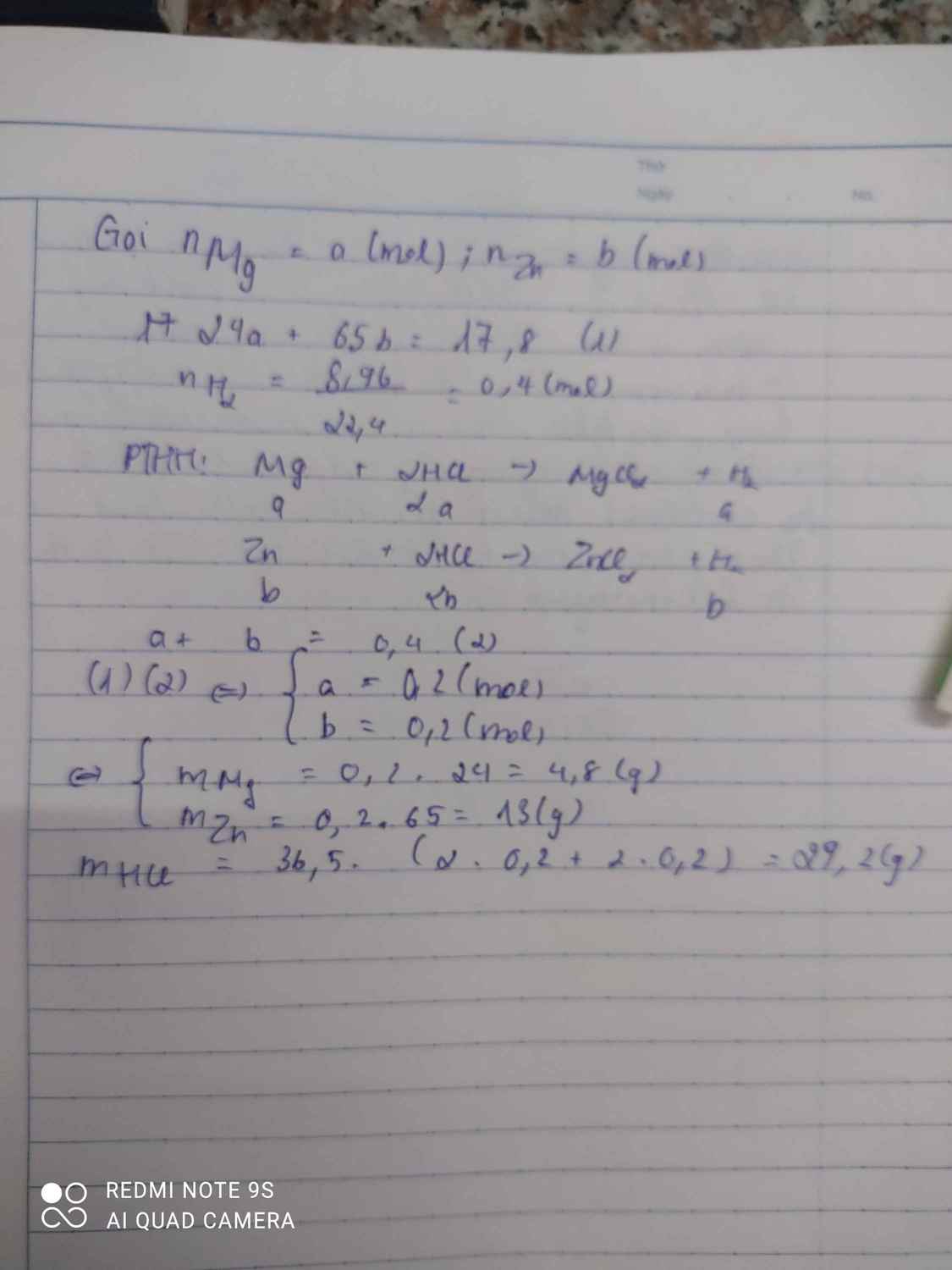
Gọi x là số mol của Al, Zn
nH2 = \(\dfrac{13,44}{22,4}=0,6\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
......x........................................1,5x
.....Zn + 2HCl --> ZnCl2 + H2
......x....................................x
Ta có: 1,5x + x = 0,6
=> x = 0,24
mhh = 0,24 . (27 + 65) = 22,08 (g)
Theo pt ta có: nHCl = 2nH2 = 2 . 0,6 = 1,2 mol
mHCl = 1,2 . 36,5 = 43,8 (g)
thế mAl và m Zn ở đâu ạ