Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

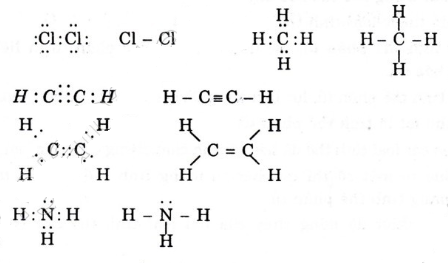
Công thức electron và công thức cấu tạo của các phân tử sau :

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
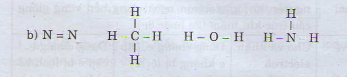
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

HD:
CT oxit cao nhất của R với oxi là R2O5 (suy ra từ RH3).
Ta có: 80/(2R+80) = 0,5634 suy ra: R = 14 (N).
H:N:H H cấu tạo: H-N-H H
Hóa trị cao nhất vs khí H là 3
>> hóa trị cao nhất vs O là 8_3=5
>>hợp chất vs oxit cao nhất là R2O5
Có %mO=56.34%
Xét tỉ số MO/Mo+MR =%mo
Hay80/80+2×MR=0.5634
>>MR=14(N)
>>hợp chất vs oxit cao nhất là N2O5
b) hợp chất vs H là NH3

Đề Nguyễn Gia Thiều năm 2017 - 2018
CT là H2O2
3) H2O2 + Ba(OH)2 ⇌ BaO2 + 2H2O
PUHH trên chứng tỏ H2O2 có tính oxi hóa ...

a. Công thức Lewis của CO2: 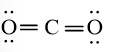
Công thức cấu tạo của CO2 là: O = C = O.
Công thức Lewis của NH3 là: 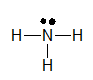
Công thức cấu tạo của NH3 là: \(H-N-H\)
\(|\)
H
b. Hợp chất tan trong nước: CO2 và NH3
Trong CO2CO2 chứa hai liên kết cộng hóa trị phân cực C=OC=O (đều phân cực về phía OO). Tuy nhiên, CO2CO2 có cấu trúc phân tử thẳng (O=C=OO=C=O) → 2 vectơ mô men cực cùng phương, ngược hướng triệt tiêu nhau → Phân tử CO2CO2 không phân cực nên có tan trong nước song là ít tan
+ NH3 tan tốt trong nước vì NH3 có liên kết cộng hóa trị phân cực trong phân tử