
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Lực đẩy của nước tác dụng vào hai thỏi tính bằng công thức:
F1 = d.V1; F2 = d.V2 (trong đó d là trọng lượng riêng của nước, V1 là thể tích của thỏi nhôm, V2 là thể tích của thỏi đồng)
Vì hai thỏi có trọng lượng như nhau: P1 = P2 và trọng lượng riêng của đồng lớn hơn của nhôm d1 < d2 nên V1 > V2, do đó F1 > F2.
Vậy cân sẽ không cân bằng nữa khi nhúng ngập cả hai thỏi đồng thời vào hai bình đựng nước.
F1 = d.V1; F2 = d.V2 (trong đó d là trọng lượng riêng của nước, V1 là thể tích của thỏi nhôm, V2 là thể tích của thỏi đồng)
Vì hai thỏi có trọng lượng như nhau: P1 = P2 và trọng lượng riêng của đồng lớn hơn của nhôm d1 < d2 nên V1 > V2, do đó F1 > F2.
Vậy cân sẽ không cân bằng nữa khi nhúng ngập cả hai thỏi đồng thời vào hai bình đựng nước.


`#3107.101107`
`6.`
`a.`
PTHH: \(\text{Fe}_2\text{O}_3+3\text{H}_2\rightarrow\text{2Fe + 3H}_2\text{O}\)
`b.`
Số mol của Fe thu được trong pứ trên là:
\(\text{n}_{\text{Fe}}=\dfrac{\text{m}_{\text{Fe}}}{\text{M}_{\text{Fe}}}=\dfrac{11,2}{56}=0,2\left(\text{mol}\right)\)
Theo PT: `1` mol Fe2O3 thu được `2` mol Fe
`=> 0,1` mol Fe2O3 thu được `0,2` mol Fe
Khối lượng mol của Fe2O3 là:
\(\text{M}_{\text{Fe}_2\text{O}_3}=\text{M}_{Fe}\cdot2+\text{M}_{\text{O}}\cdot3=56\cdot2+16\cdot3=160\text{ (g/mol)}\)
Khối lượng của Fe2O3 có trong pứ trên là:
\(\text{m}_{\text{Fe}_2\text{O}_3}=\text{n}_{\text{Fe}_2\text{O}_3}\cdot\text{M}_{\text{Fe}_2\text{O}_3}=0,1\cdot160=16\left(g\right)\)
Vậy, m của Fe2O3 có trong pứ trên là `16` g.
_____
Theo PT: `3` mol H2 thu được `2` mol Fe
`=> 0,3` mol H2 thu được `0,2` mol Fe
Thể tích của khí H2 trong pứ trên là:
\(\text{V}_{\text{H}_2}=\text{n}_{\text{H}_2}\cdot24,79=0,2\cdot24,79=4,958\left(l\right)\)
Vậy, V của H2 trong pứ trên là `4,958` l.

a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b) \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
Theo PTHH: \(n_{AlCl_3}=n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=0,1\cdot133,5=13,35\left(g\right)\)
c) Theo PTHH: \(n_{H_2}=\dfrac{0,1\cdot3}{2}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2,25^o1bar}=0,15\cdot24,79=3,7185\left(l\right)\)
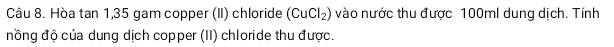









 Giải hết và chi tiết với ạ. Em đang cần gấp ạ. Em cảm ơn nhiều ạ.
Giải hết và chi tiết với ạ. Em đang cần gấp ạ. Em cảm ơn nhiều ạ.
\(n_{CuCl_2}=\dfrac{1,35}{135}=0,01mol\\ 100ml=0,1l\\ C_{M_{CuCl_2}}=\dfrac{0,01}{0,1}=0,1M\)