Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sửa đề : tỉ khối là 1.25
a)Ta có:
Phương trình phản ứng:
C + O2 -> CO2 (1)
C + CO2 -> 2CO (2)
Bài toán này có thể xảy ra hai trường hợp sau:
Trường hợp 1: Oxi dư (không có phản ứng 2): Hỗn hợp A gồm CO2 và O2 dư.
Thành phần phần trăm các chất trong hỗn hợp về mặt toán học không ảnh hưởng đến số mol hỗn hợp.
Xét 1 mol hỗn hợp A, trong đó X là số mol của CO2 và (1 - x) là số mol của O2 dư.
Vậy: %VCO2 = 2/3. 100% = 66,67% và %VO2 = 33,33%.
Trường hợp 2: O2 thiếu (có phản ứng 2), hỗn hợp A có CO2 và CO.
Tương tự trên, xét 1 mol hỗn hợp A, trong đó a là số mol của CO2 và (1 - a) là số moi của CO
Vậy %VCO2 = 0,75. 100% = 75%; %VCO = 100% - 75% = 25%.
b)
Trường hợp 1: nCO2 = 0,06 mol ⇒ nO2 dư = 1/2 nCO2 = 0,03 (mol)
Vậy: mC = 0,06.12 = 0,72 gam; VO2 = (0,06 + 0,03).22,4 = 2,016 (lít).
Trường hợp 2: nCO2 = 0,06mol; nCO = nCO2/3 = 0,02(mol)
BT nguyên tố C ⇒ nC = nCO2 +nCO = 0,06 + 0,02 = 0,08 mol ⇒ mC = 0,08.12 = 0,96(g)
BT nguyên tố O ⇒ nO2 = nCO2 + 1/2. nCO = 0,06 + 0,01 = 0,07 mol ⇒ VO2 = 0,07.22,4 = 1,568 (lít).

Gọi số mol Fe, Cu trong m gam hỗn hợp là x,y mol
Phần 1 tác dụng H2SO4 loãng dư chỉ có Fe tác dụng
BT mol electron: \(2.\dfrac{x}{2}=2.n_{H2}=2.0,2\Rightarrow x=0,4\left(mol\right)\)
Phần 2 tác dụng H2SO4 đặc nguội chỉ có Cu tác dụng ( Fe thụ động trong H2SO4 đặc nguội
BT mol electron: \(2.\dfrac{y}{2}=2.n_{SO2}=2.0,1\Rightarrow y=0,2\left(mol\right)\)
a) m=56.0,4 + 64.0,2=35,2(g)
b) m gam tác dụng H2SO4 đặc nóng dư thu được muối Fe2(SO4)3 0,2 mol, CuSO4 0,2 mol
mmuối= 0,2.400 + 0,2.160=112(g)

nCu= x mol; nAg= y mol
Cu + 2H2SO4→ CuSO4 + SO2↑ + H2O (1)
2Ag + 2H2SO4→ Ag2SO4 + SO2↑ + 2H2O (2)
SO2(k) + Br2 + 2H2O → H2SO4 + 2HBr (3)
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (4)
Theo PTPU (4), ta có: n↓= nBaSO4= nH2SO4 (4)= 0,08 mol
Theo PTPU (3), ta có: nSO2= nH2SO4 (4)= 0,08 mol
Theo PTPU (1) và (2), ta có: nSO2= nCu + 2nAg = x + 0,5y = 0,08 mol (5)
Tổng khối lượng hỗn hợp ban đầu: mhỗn hợp= mCu + mAg = 64x + 108y = 11,2 (6)
Giải hệ hai phương trình (5) và (6) ta được: x= 0,04 ; y= 0,08
→mCu= 0,04x64= 2,56 (g) →%mCu=2,56/11,2x100% = 22,86%
→%mAg= 100% - %mCu= 77,14%

\(m_A=m_{S\left(dư\right)}=0,8\left(g\right)\)
\(\overline{M}_D=9.2=18\)
\(CuCl_2+H_2S\rightarrow CuS+2HCl\)
\(\Rightarrow n_{H2S}=n_{CuS\downarrow}=\frac{9,6}{96}=0,1\left(mol\right)\)
Gọi x là mol H2 trong D
\(\Rightarrow\frac{0,1.34+2x}{0,1+x}=18\)
\(\Leftrightarrow x=0,1\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe\left(dư\right)}=0,1\left(mol\right)\\n_{FeS}=0,1\left(mol\right)\end{matrix}\right.\)
\(Fe+S\rightarrow FeS\)
\(\Sigma n_{Fe}=0,1+0,1=0,2\left(mol\right)\)
\(\Rightarrow m_1=0,2.56=11,2\left(g\right)\)
\(\Rightarrow m_2=m_S=0,8+0,1.32=4\left(g\right)\)
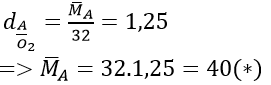
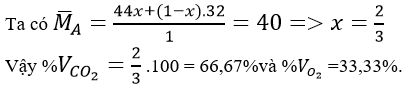
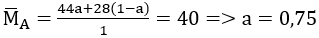
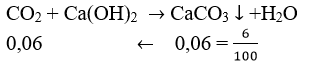
A gồm hai khí CO(M = 28), CO2(M = 44)
Suy ra: \(28< M_A < 44\)
Mà theo đề bài : \(M_A = M_{H_2} .1,25 = 2.1,25 = 2.5\)
→ Sai đề
C + O2 -to-> CO2
CO2 + Ca(OH)2 -> CaCO3 + H2O
nCaCO3=0,06(mol) ->nC= nCO2=0,06(mol)
=> m=mC=0,06.12=0,72(g)
dA=H2=1,25 -> M(A)=2,5 ???
Nhỏ hơn cả M(O2) và M(CO2), anh nghĩ là đề có nhầm lẫn. Em xem lại nhé!