Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\frac{n_C}{n_S}=\frac{3}{2}=1,5=>n_C=1,5n_S\)
gọi số mol S là x => số mol C là 1,5x
theo đề ra ta có : 32x+12.1,5x=5(g)
=> 32x + 18x = 5
=> x = 0,1(mol)
=> \(m_S=0,1.32=3,2\left(g\right)\)
=> \(m_C=5-3,2=1,8\left(g\right)\)
b , \(S+O_2->SO_2\left(1\right)\)
\(C+O_2->CO_2\left(2\right)\)
\(M_B=21.2=42\left(g\right)\)
\(M_B< M_{CO_2}< M_{SO_2}\)
=> trong B có \(O_2\left(dư\right)\)
theo (1) \(n_{SO_2}=n_S=0,1\left(mol\right)\)
theo (2) \(n_{CO_2}=n_C=\frac{1,8}{12}=0,15\left(mol\right)\)
gọi n là số mol \(O_2\)dư , ta có
\(M_B=\frac{0,1.64+0,15.44+32n}{0,1+0,15+n}=42\)
=> 6,4 + 6,6 + 32n = 4,2+ 6,3 + 42n
=> 2,5 = 10n
=> n = 0,25(mol)
theo (1) \(n_{O_2\left(pư\right)}=n_S=0,1\left(mol\right)\) , theo (2) \(n_{O_2\left(pư\right)}=n_C=0,15\left(mol\right)\)
=> \(V_{O_2}=\left(0,25+0,15+0,1\right).22,4=11,2\left(l\right)\)

a)\(3Fe+2O2-->Fe3O4\)(1)
3x<----------2x(mol)
\(S+O2-->SO2\)(2)
x<----x(mol)
b) Gọi \(n_{O2}\left(2\right)=x\Rightarrow n_{O2}\left(1\right)=2x\left(mol\right)\)
( do tỉ lệ số mol mà O2 tác dụng với lưu huỳnh so với số mol O2 tác dụng với Fe là 1:2)
\(n_{O2}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
\(\Rightarrow x+2x=0,6\Rightarrow x=0,2\)
\(m_{hh}=0,6.56+0,2.64=46,4\left(g\right)\)
\(\%m_{Fe}=\frac{0,6.56}{46,4},100\%=72,41\%\)
\(\%m_S=100-72,41=27,59\%\)
a, \(3Fe+2O_2\rightarrow Fe_3O_4\)
\(S+O_2\rightarrow SO_2\)
b)
Gọi a là số mol Fe b là số mol S
\(\Rightarrow n_{O2_{thm.gia.voi.Fe}}=\frac{2a}{3}\left(mol\right)\)
\(n_{O2_{tham.gia.vơi.S}}=b\left(mol\right)\)
Ta có
\(b:\frac{2a}{3}=1:2\Rightarrow a=3b\)
\(\frac{2a}{3}+b=6\Rightarrow2b+b=6\)2
\(\Rightarrow\left\{{}\begin{matrix}a=6\\b=2\end{matrix}\right.\)
\(\%m_{Fe}=\frac{56.6}{56.6+2.32}.100\%=84\%\)
\(\%m_S=100\%-84\%=16\%\)

MX= 19.2=38
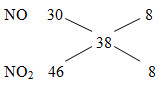
=> nN2=nNO2=x
mFe + mO = moxit
=> mO = moxit- mFe = 7,36-5,6=1,76 gam
=> nO = 0,11 mol
Fe0 →Fe3+ + 3e
0,1 0,3
O0 +2e →O2- N+5 + 3e → N+2 N+5 +1e → N+4
0,11 0,22 3x x x x
Bảo toàn e: 0,3 = 0,22+3x+x =0,22+4x =>x= 0,02
=> nkhí = 2x=0,04 mol
=> Vkhí = 0,04.22,4=0,896 lít=896 ml

PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\) (1)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\) (2)
a) Gọi số mol của Mg là a (mol) \(\Rightarrow n_{Al}=\dfrac{2}{3}a\left(mol\right)\)
\(\Rightarrow24a+27\cdot\dfrac{2}{3}a=6,3\) \(\Rightarrow a=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{MgO}=0,15\left(mol\right)\\n_{Al_2O_3}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{MgO}=0,15\cdot40=6\left(g\right)\\m_{Al_2O_3}=0,05\cdot102=5,1\left(g\right)\end{matrix}\right.\)
b) Theo các PTHH: \(\left\{{}\begin{matrix}n_{O_2\left(1\right)}=0,075\left(mol\right)\\n_{O_2\left(2\right)}=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\Sigma n_{O_2}=0,15\left(mol\right)\) \(\Rightarrow V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\)

1, a, + 8.2=16 => CH4
+ 8,5 . 2 = 17 => NH3
+ 16 . 2 =32 => O2
+ 22 . 2 = 44 => CO2
b, + 0,138 . 29 \(\approx4\) => He
+ 1,172 . 29 \(\approx34\) => H2S
+ 2,448 . 29 \(\approx71\Rightarrow Cl_2\)
+ 0,965 . 29 \(\approx28\) => N

Giả sử x chứa 1 mol N2 và x mol H2
\(n_X=1+x\)
\(m_X=28+2x\)
\(\Rightarrow M_X=\frac{28+2x}{1+x}=3,6.2=7,2\)
\(\Rightarrow x=4\)
Phản ứng xảy ra:
\(N_2+3H_2\rightarrow2NH_3\)
Vì \(n_{H2}>3n_{N2}\) nên hidro dư so với nito.
Hiệu suất tính theo nito.
Gọi số mol nito phản ứng là a, suy hidro phản ứng là 3a.
Sau phản ứng hỗn hợp chứa N2 1-a mol; H2 4-3a mol và NH3 2a mol
Ta có:
\(n_Y=1-a+4-3a+2a=5-2a\)
\(m_X=m_Y=36\Rightarrow M_Y=\frac{36}{5-2a}=4.2=8\Rightarrow a=0,25\)
\(\Rightarrow H=\frac{0,25}{1}.100\%=25\%\)

Giả sử có 1 mol khí Cl2, 2 mol khí O2
a) \(\left\{{}\begin{matrix}\%V_{Cl_2}=\dfrac{1}{1+2}.100\%=33,33\%\\\%V_{O_2}=\dfrac{2}{1+2}.100\%=66,67\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Cl_2}=\dfrac{1.71}{1.71+2.32}.100\%=52,59\%\\\%m_{O_2}=\dfrac{2.32}{1.71+2.32}.100\%=47,41\%\end{matrix}\right.\)
b) \(\overline{M}=\dfrac{1.71+2.32}{1+2}=45\left(g/mol\right)\)
=> \(d_{A/H_2}=\dfrac{45}{2}=22,5\)
c) \(n_A=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> mA = 0,3.45 = 13,5 (g)


\(S+O_2->SO_2\left(1\right)\)
\(C+O_2->CO_2\)
\(\frac{m_C}{m_S}=\frac{9}{16}\) => \(m_C=5:\left(9+16\right).9=1,8\left(g\right)\)
=> \(m_S=5-1,8=3,2\left(g\right)\)
=> \(n_C=\frac{1,8}{12}=0,15\left(mol\right)\) , \(n_S=\frac{3,2}{32}=0,1\left(mol\right)\)
theo (1) và (2) , \(n_{O_2}=n_C+n_S=0,25\left(mol\right)\)
=> \(V_{O_2}=22,4.0,25=5,6\left(l\right)\)
b, \(S+O_2->SO_2\) (1)
\(C+O_2->CO_2\) (2)
the0 (1) \(n_{SO_2}=n_S=0,1\left(mol\right)\)
theo (2) \(n_{CO_2}=n_C=0,15\left(mol\right)\)
\(M_B=\frac{0,2.64+0,15.44}{0,25}=52\left(g\right)\)
tỉ khối của khí B so với \(H_2\) là
\(\frac{52}{2}=26\)