Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
PTHH: Fe + 2HCl ===> FeCl2 + H2
a/ nFe = 11,2 / 56 = 0,2 mol
=> nH2 = 0,2 mol
=> VH2(đktc) = 0,2 x 22,4 = 4,48 lít
b/ => nHCl = 0,2 x 2 = 0,4 mol
=> mHCl = 0,4 x 36,5 = 14,6 gam
c/ => nFeCl2 = 0,2 mol
=> mFeCl2 = 0,2 x 127 = 25,4 gam
Câu 3/
a/ Chất tham gia: S, O2
Chất tạo thành: SO2
Đơn chất: S, O2 vì những chất này chỉ do 1 nguyên tố tạo nên
Hợp chất: SO2 vì chất này do 2 nguyên tố S và O tạo tên
b/ PTHH: S + O2 =(nhiệt)==> SO2
=> nO2 = 1,5 mol
=> VO2(đktc) = 1,5 x 22,4 = 33,6 lít
c/ Khí sunfuro nặng hơn không khí

câu 1: nAl=0,4 mol
mHCL=54,75g=> nHCl=1,5 mol
PTHH: 2Al+6HCl=> 2AlCl3+3H2
0,4mol: 1,5mol => nHCl dư theo nAl
0,4mol-->1,2 mol-->0,4mol-->0,6mol
thể tích H2 là V=0,6.22,4=13,44ml
b) theo định luật btoan khối lượng ta có : mAlCl3=200+10,8-0,6.2=209,6g
m AlCl3=0,4.(27+35,5.3)=53,4g
=> C% AlCl3= 25,48%
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
Khối lượng chất tan HCl là:
200 . 27,375% = 54,75(gam)
Số mol của HCl là: 54,75 : 36,5 = 1,5 (mol)
Số mol của Al là: 10,8 : 27 = 0,4 (mol)
So sánh: \( {0,4{} \over 2}\) < \({1,5} \over 6\)
=> HCl dư, tính theo Al
Số mol của khí hiđrô sinh ra là: 0,4 . \(3 \ \over 2\) = 0,6 (mol)
V= 0,6 . 22,4 = 13,44 (lít)
Sau đó áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch A:
Khối lượng nhôm + Khối lượng dung dịch axit
= Khối lượng dung dịch A + khối lượng khí hiđrô
<=> Khối lượng dung dịch A là:
10,8 + 200 - 0,6 . 2 = 209,6 (gam)
Khối lượng chất tan AlCl3 trong dung dịch A là:
0,4 . 133,5 = 53,4 (gam)
C% chất tan trong dung dịch A là:
( 53,4 : 209,6 ) . 100% = 25,48%

nAl = 2,7/27 = 0,1 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,1 ---> 0,075 ---> 0,05
mAl2O3 = 0,05 . 102 = 5,1 (g)
VO2 = 0,075 . 22,4 = 1,68 (l)
Vkk = 1,68 . 5 = 8,4 (l)
\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{2,7}{27}=0,1mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,1 0,075 0,05 ( mol )
\(m_{Al_2O_3}=n_{Al_2O_3}.M_{Al_2O_3}=0,05.102=5,1g\)
\(V_{kk}=V_{O_2}.5=\left(0,075.22,4\right).5=8,4l\)

a) nAl=0,2(mol)
PTHH: 4Al +3 O2 -to-> 2 Al2O3
nO2=3/4. 0,2=0,15(mol)
=>V(O2,đktc)=0,15.22,4=3,36(l)
b) V(kk,đktc)=3,36.5=16,8(l)

a) $2Mg + O_2 \xrightarrow{t^o} 2MgO$
Theo PTHH : n MgO = n Mg = 2,4/24 = 0,1(mol)
=> m MgO = 0,1.40 = 4(gam)
b) n O2 = 1/2 n Mg = 0,05(mol)
=> V O2 = 0,05.22,4 = 1,12(lít)
=> V không khí = 5V O2 = 1,12.5 = 5,6(lít)
c) $Mg + 2HCl \to MgCl_2 + H_2$
n HCl = 200.15%/36,5 = 60/73(mol)
Ta thấy :
n Mg / 1 = 0,1 < n HCl / 2 = 30/73 suy ra HCl dư
n H2 = n Mg = 0,1(mol)
=> m dd sau pư = 2,4 + 200 - 0,1.2 = 202,2(gam)
Vậy :
C% MgCl2 = 0,1.95/202,2 .100% = 4,7%
C% HCl = (60/73 - 0,1.2).36,5/202,2 .100% = 11,23%
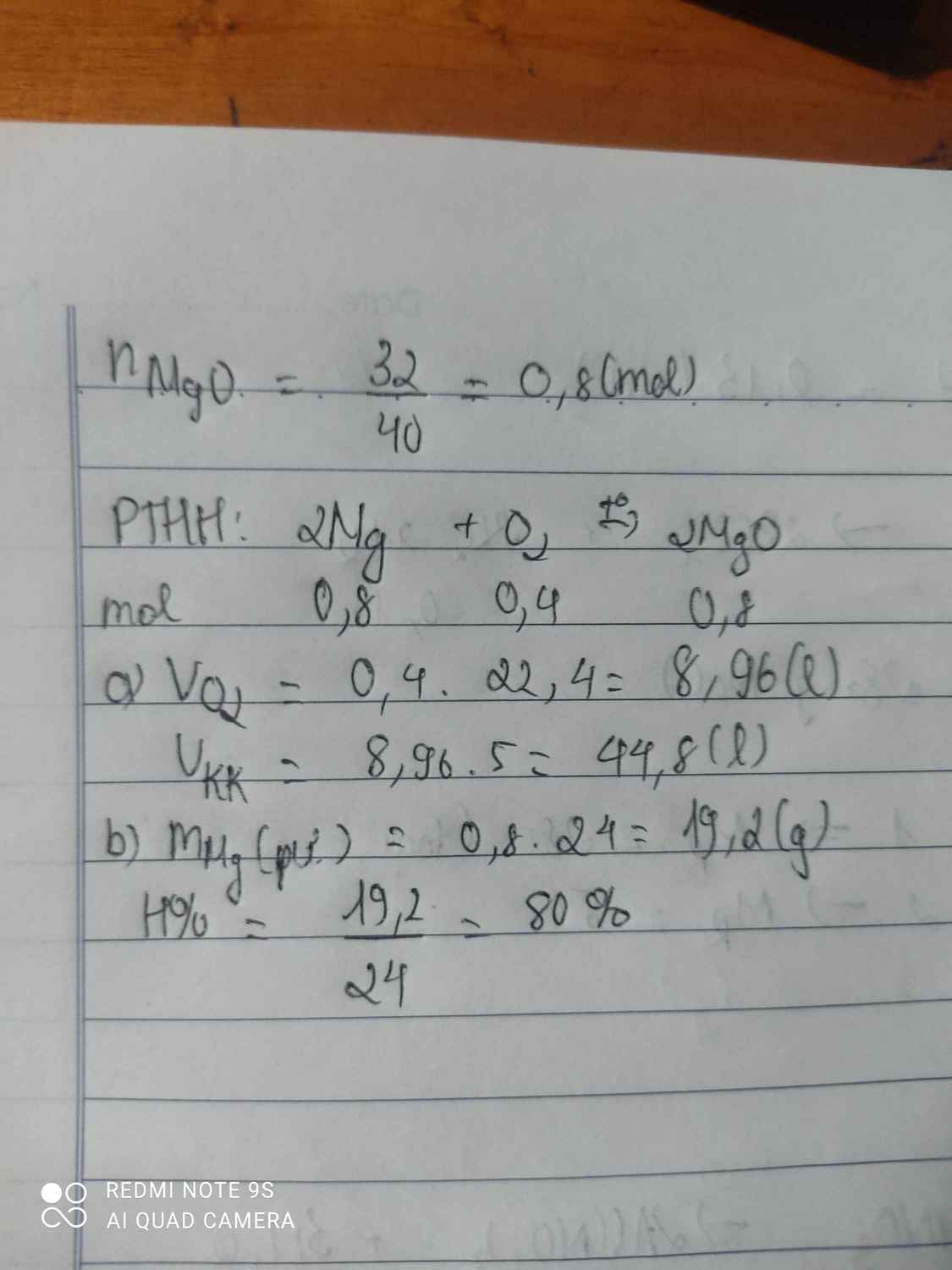
a) \(4Al+3O_2-^{t^o}\rightarrow2Al_2O_3\)
Bảo toàn khối lượng : \(m_{O_2}=12,24-8,1=4,14\left(g\right)\)
=>\(n_{O_2}=\dfrac{207}{1600}\left(mol\right)\)
Vì O2 chiếm 20% thể tích không khí
\(V_{kk}=\dfrac{\dfrac{207}{1600}.22,4}{20\%}=14,49\left(lít\right)\)
b) \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,3}{4}>\dfrac{\dfrac{207}{1600}}{3}\)
=> Sau phản ứng Al dư
\(n_{Al\left(pứ\right)}=\dfrac{207}{1600}.\dfrac{4}{3}=0,1725\left(mol\right)\)
=> \(H=\dfrac{0,1725}{0,3}.100=57,5\%\)
c) D gồm Al2O3 và Al dư
\(n_{Al_2O_3}=\dfrac{2}{3}n_{O_2}=\dfrac{69}{800}\left(mol\right);n_{Al\left(dư\right)}=0,3-0,1725=0,1275\left(mol\right)\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Sigma n_{HCl}=\dfrac{69}{800}.6+0,1275.3=0,9\left(mol\right)\)
=> \(m_{HCl}=0,9.36,5=32,85\left(g\right)\)