Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bài 1
(1)Fe + CuSO4 →→ FeSO4 + Cu
(2)Fe + 2HCl →→ FeCl2 + H2
(3)FeSO4 + 2NaOH →→ Fe(OH)2 + Na2SO4
a) rắn A có Fe dư và Cu
Cho vào HCl dư rắn ko phản ứng là Cu
Theo (1) : nCu = nCuSO4 = 1.0,01 = 0,01 (mol)
→→ mCu = 0,01 . 64 =0,64 (g)
b) Dd B là FeSO4
Theo (1) : nFeSO4 = nCuSO4 = 0,01 (mol)
Theo (3) nNaOH = 2nFeSO4 = 2.0,01 = 0,02 (mol)
VNaOH = 0,02 : 1 = 0,02 (l)\
bài 2
Fe+CuSO4-->FeSO4+Cu
x-----x--------------------x
mtăng=mCu-mFepư=64x-56x=0,8
->x=0,1
CmCuSO4=0,1\0,2=0,5 M

a,
Gỉa sử hỗn hợp A phản ứng hết với CuSO\(_4\) thì dung dịch sau phản ứng chứa Magie sunfat và sắt (2) sunfat . Sau đó cho NaOH vào để lấy tủa và nung tủa đến khối lượng không đổi thì được rắn gồm Magie oxit và sắt (3) oxit và khối lượng của rắn này phải lớn hơn khối lượng của hỗn hợp A ban đầu
Mà m\(_D\) < m\(_A\) ⇒ ban đầu rắn B có kim loại dư và CuSO\(_4\) phản ứng hết
Do Mg > Fe ⇒ sau khi phản ứng với CuSO\(_4\) thì Fe dư
Đặt a = n\(_{Mg}\) (mol) ; b = n\(_{Fe_{pư}}\)(mol) ; c = n\(_{Fe_{dư}}\) (mol)
ta có phương trình :
24a + 56b + 56c = 5,1 (I)
Mg + CuSO\(_4\) → MgSO\(_4\) + Cu
(mol) a → a → a → a
Fe + CuSO\(_4\) → FeSO\(_4\) + Cu
(mol) b → b → b → b
Rắn B có Cu và Fe dư
ta có m\(_B\) = 64a + 64b + 56c
\(\Leftrightarrow\) 64a + 64b + 56c = 6,9 (II)
dung dịch C chứa FeSO\(_4\) : b (mol) và MgSO\(_4\): a (mol)
NaOH dư + dung dịch C
2NaOH + MgSO\(_4\) → Mg(OH)\(_2\)↓ + Na\(_2\)SO\(_4\)
(mol) a → a
2NaOH + FeSO\(_4\) → Fe(OH)\(_2\) ↓ + Na\(_2\)SO\(_4\)
(mol) b → b
Mg(OH)\(_2\) →t\(^0\) MgO + H\(_2\)O
(mol) a → a
4Fe(OH)\(_2\) + O\(_2\) →t\(^0\) 2Fe\(_2\)O\(_3\) + 4H\(_2\)O
(mol) b → 0,5b
rắn D gồm Fe\(_2\)O\(_3\) và MgO
m\(_D\) = 40a + 160*0,5b
\(\Leftrightarrow\) 40a + 80b = 4,5 (III)
Girai hệ phương trình (I) , (II) và (III) ta được
a = 0,0375 (mol)
b =0,0375 (mol)
c = 0,0375 (mol)
\(\Rightarrow\) \(\Sigma\)n\(_{Fe}\) = b+c = 0,0375 + 0,0375 =0,075 (mol)
⇒ m\(_{Mg}\) = 24*0,0375 = 0,9 (gam)
m\(_{Fe_{bandau}}\) = 56 * 0,075 = 4,2 (gam)
b,
\(\Sigma\)n\(_{CuSO_4}\) = a + b = 0,0375 + 0,0375 = 0,075 (mol)
⇒ C\(_{M_{CuSO_4}}\)= \(\dfrac{0,075}{\dfrac{250}{1000}}\)= 0,3 (M)

nMg = 3,6/24 = 0,15 mol; nFeCl3 = 0,25.1 = 0,25 mol
Mg + 2FeCl3 → MgCl2 + 2FeCl2
0,125dư 0,025←0,25 → 0,125 → 0,25 (mol)
Mg + FeCl2 → MgCl2 + Fe
0,025→0,025 →0,025→0,025 (mol)
Vậy chất rắn sau phản ứng là Fe: nFe = 0,025 mol
=> m = mFe = 0,025.56 = 1,4 (gam)
Dung dịch X sau phản ứng gồm:
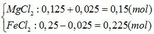
Nồng độ của các chất trong dung dịch X:
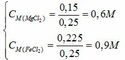

C tác dụng với NaOH dư thu được 2 hidroxit kết tủa → C còn 2 muối
→ C còn Fe(NO3)2 và Cu(NO3)2 dư
\(\text{Fe(NO3)2 + 2NaOH → 2NaNO3 + Fe(OH)2↓}\)
\(\text{Cu(NO3)2 + 2NaOH → 2NaNO3 + Cu(OH)2↓}\)
Gọi số mol Fe(OH)2, Cu(OH)2 lần lượt là x, y
4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O
..x............................x/2.............................(mol)
Cu(OH)2 → CuO + H2O
...y...................y...................(mol)
Giải HPT:
\(\left\{{}\begin{matrix}\text{90
x
+
98
y
=
18
,
4
}\\80x+80y=16\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{
x
=
0
,
15}\\y=0,05\end{matrix}\right.\)
Gọi số mol Fe phản ứng với AgNO3, Cu(NO3)2 lần lượt là a, b
\(\text{Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓}\)
a............. 2a..................a.................2a.............(mol)
\(\text{Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓}\)
b...............b.......................b..............b..............(mol)
mcr = mAg + mCu = 2a.108 + 64b = 216a + 64b = 17,2
\(\text{nFe(NO3)2 = a + b = 0,15 }\)
→ a = 0,05; b = 0,1
a) mFe = (0,05 + 0,1) . 56 = 8,4g
b) nAgNO3 = 2 . 0,05 = 0,1 mol
\(\text{→ CM (AgNO3) = 0,1 : 0,5 = 0,2M}\)
nCu(NO3)2 dư = nCu(OH)2 = 0,05 mol
nCu(NO3)2 = 0,05 + 0,1 = 0,15 mol
\(\text{CM (Cu(NO3)2) = 0,15 : 0,5 = 0,3M}\)

a, Theo gt ta có: $n_{Al/phan1}=0,01(mol);n_{Cu/phan1}=0,05(mol);n_{O_2/tgpu2}=0,04(mol)$
Suy ra $n_{Al/phan2}=0,01k(mol);n_{Cu/phan2}=0,05k(mol)$
Bảo toàn e ta có: $0,03k+0,1k=0,16$
$\Rightarrow k=\frac{16}{13}$ (Hơi lẻ nhỉ)
Do đó $m_{Al}=\frac{783}{1300}(g);m_{Cu}=\frac{464}{65}(g)$
b, $3CuSO_4+2Al\rightarrow Al_2(SO_4)_3+3Cu$
Ta có: \(\Sigma n_{Al}=\frac{29}{390}+0,01+0,01.\frac{16}{13}=\frac{29}{300}\left(mol\right)\)
Vậy $m_{Al}=2,61(g)$
c, Bảo toàn nguyên tố Cu ta có: \(n_{CuSO_4}=0,05+0,05.\frac{16}{13}=\frac{29}{260}\left(mol\right)\)
Suy ra \(C_{M_{CuSO_4}}=\frac{29}{52}M\)

\(n_{CuSO_4}=1.0,01=0,01(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\)
Do Cu ko td với HCl nên chất rắn sau phản ứng vẫn là Cu
\(n_{Cu}=n_{Fe}=0,01(mol)\\ \Rightarrow m_{Cu}=0,01.64=0,64(g)\\ b,PTHH:FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{NaOH}=2n_{FeSO_4}=2n_{Fe}=0,02(mol)\\ \Rightarrow V_{dd_{NaOH}}=0,02.1=0,02(l)\)

Bài 1 :
nFe = 0,25 mol; nAgNO3 = 0,2 mol; nCu(NO3)2 = 0,05 mol.
Giữa Ag+ và Cu2+ thì Ag+ có tính oxi hóa mạnh hơn Cu2+, nên Ag+ tham gia phản ứng với Fe trước, sau khi Ag+ tham gia phản ứng hết nếu còn dư Fe thì Cu2+ mới tiếp tục tham gia.
Fe + 2Ag+ → Fe2+ + 2Ag (VII)
nFe = 0,25 mol; nAg+ = 0,2 mol → Fe dư sau phản ứng (VII)
Fe + 2Ag+ → Fe2+ +2Ag
0,1 (mol) 0,2 (mol) 0,1 (mol) 0,2 (mol)
Sau phản ứng (VII) ta có: nFe còn = 0,25 – 0,1 = 0,15 mol, Ag tạo thành = 0,2 mol.
Fe + Cu2+ → Fe2+ + Cu (VIII)
nFe = 0,15 mol; nCu2+ = 0,05 mol → Fe vẫn còn dư sau phản ứng (VIII)
Fe + Cu2+ → Fe2+ + Cu
0,05 (mol) 0,05 (mol) 0,05 (mol) 0,05 (mol)
Vậy, sau phản ứng (VII) và (VIII), chất rắn thu được gồm nAg = 0,2 mol; nCu = 0,05 mol và nFe dư = 0,25 – (0,1 + 0,05) = 0,1 mol.
Nên ta có giá trị của m = mAg + mCu + mFe dư
= 0,2.108 + 0,05.64 + 0,1.56 = 30,4 gam.
Bài 2 :
Nhận xét :
- Mg sẽ tác dụng với AgNO3 trước, sau khi AgNO3 hết thì Mg mới phản ứng với Cu(NO3)2.
- Vì chưa biết khối lượng Mg tham gia là bao nhiêu, nên bài toán này ta phải chia ra các trường hợp:
+ Mg tham gia vừa đủ với AgNO3, Cu(NO3)2 chưa tham gia, chất rắn thu được là Ag tính được giá trị m1.
+ AgNO3, Cu(NO3)2 tham gia hết, Mg phản ứng vừa đủ, chất rắn tham gia gồm Ag, Cu có giá trị là m2.
Nếu khối lượng chất rắn trong 2 trường hợp nằm trong khoảng m1< 17,2 < m2 (từ dữ kiện đề bài, tính toán giá trị m1, m2) có nghĩa là Ag+ tham gia phản ứng hết, Cu2+ tham gia một phần.
Đáp số : m = 3,6gam.

(1)Fe + CuSO4 \(\rightarrow\) FeSO4 + Cu
(2)Fe + 2HCl \(\rightarrow\) FeCl2 + H2
(3)FeSO4 + 2NaOH \(\rightarrow\) Fe(OH)2 + Na2SO4
a) rắn A có Fe dư và Cu
Cho vào HCl dư rắn ko phản ứng là Cu
Theo (1) : nCu = n\(Cu SO_4\) = 1.0,01 = 0,01 (mol)
\(\rightarrow\) mCu = 0,01 . 64 =0,64 (g)
b) Dd B là FeSO4
Theo (1) : n\(Fe SO_4\) = n\(Cu SO_4\) = 0,01 (mol)
Theo (3) nNaOH = 2n\(Fe SO_4\) = 2.0,01 = 0,02 (mol)
VNaOH = 0,02 : 1 = 0,02 (l)
Ciao_

Fe + CuSO4 -> FeSO4 + Cu
nCuSO4=0,02.1=0,02(mol)
Theo PTHH ta có:
nFeSO4=nCuSO4=nCu=nFe=0,02(mol)
mCu=64.0,02=1,28(g)
mFe dư=4,08-1,28=2,8(g)
mFe tham gia PƯ=56.0,02=1,12(g)
\(\sum\)mFe=2,8+1,12=3,92(g)
CM dd FeSO4=\(\dfrac{0,02}{0,02}=1M\)
CM=\(\dfrac{n}{V}\)
n là số mol của chất tan sau phản ứng
V là số lít của dd ban đầu(luôn ko đổi dù có kết tủa hay có khí bay ra)Vịtt Tên Hiền