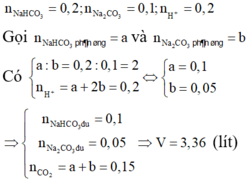Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nH+ = 0,1.0,01 = 0,001
dung dịch X có pH=12 ⇒ nOH-/X = 0,001
⇒ nOH- ban đầu = n H+ + n OH-/X = 0,002
⇒ nBa = ½ nOH- ban đầu = 0,001
⇒ mBa = 0,137g
Ba + 2H2O → Ba(OH)2 + H2
⇒ nH2 = nBa = 0,001mol ⇒ V = 22,4ml
Đáp án B.

Đáp án D
Dung dịch C có pH =7 ⇒ nH+ = nOH- ⇒ 0,1.0,1.2 + 0,2.0,1 = 0,2V + 0,3V
⇒ V =0,08l = 80 ml
Đáp án D.

\(n_{HCl}=0,2\cdot0,1=0,02mol\\ n_{H_2}=\dfrac{0,336}{22,4}=0,015mol\\ 2Na+2HCl\rightarrow2NaCl+H_2\uparrow\)
0,02 > 0,015
\(n_{HCldư}=0,02-0,015=5\cdot10^{-3}mol\\C_{M_X}=\dfrac{5\cdot10^{-3}}{0,1}=0,05M\)
\(\Rightarrow pH=1,3\)

Đáp án B
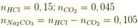
![]()
![]()
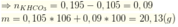
Khi cho từ từ X vào HCl thì tác dụng với HCl theo tỷ lệ số mol
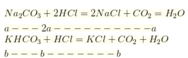
ta có: ![]()
![]()

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

Ta có: \(\Sigma n_{H^+}=0,1.0,1.2+0,1.0,2=0,04\left(mol\right)\)
\(\Sigma n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
_____0,04____0,04_________ (mol)
⇒ H+ pư vừa đủ với OH-
⇒ a = pH = 7
Ta có: \(n_{SO_4^{2-}}=0,1.0,1=0,01\left(mol\right)\)
\(n_{Ba^{2+}}=0,1.0,1=0,01\left(mol\right)\)
PT ion: \(SO_4^{2-}+Ba^{2+}\rightarrow BaSO_{4\downarrow}\)
_______0,01___0,01______0,01___ (mol)
\(\Rightarrow m=m_{BaSO_4}=0,01.233=2,33\left(g\right)\)
Bạn tham khảo nhé!