Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
|
|
AgNO3 |
K2CO3 |
| Ban đầu |
0,6 mol; 102 gam |
0,9 mol; 124,2 gam |
| Thêm vào |
→ HCl : 0 , 1 mol ↓ AgCl : 0 , 6 mol |
← H 2 SO 4 : 0 , 25 ↑ CO 2 : 0 , 25 |
| Sau phản ứng |
115,9gam |
213,2 gam |
| Thêm nước |
213,2 – 115,9 = 97,3 gam |
|
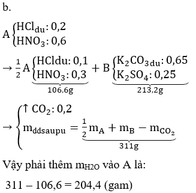

b) $n_{HCl} = 0,6(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
$n_{Mg} : 1 = 0,2 < n_{HCl} : 2 = 0,3$ nên HCl dư
$n_{H_2} = n_{Mg} = \dfrac{4,8}{24} = 0,2(mol)$
$\Rightarrow m_{tăng} = m_{Mg} - m_{H_2} = 4,8 - 0,2.2 = 4,4(gam)$
$n_{MgCO_3} = 0,1(mol)$
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$n_{MgCO_3} : 1 = 0,1 < n_{HCl} : 2$ nên HCl dư
$n_{CO_2} = n_{MgCO_3} = 0,1(mol)$
$\Rightarrow m_{tăng} = 8,4 - 0,1.44 = 4(gam)$
Vì 4,4 > 4 nên cân bị lệnh về phía cốc A

n NaHCO3=0,126 mol
n Al =0,74 mol
+) thêm vào cốc phải : gọi n AL pư =a mol
a-> 3a-> 1,5a
m dung dịch HCl thêm 3a.36,5/7,3%=1500a g
m H2 =3a
3a< 1500a
-> m cốc phải tăng lên luôn > m cốc trái
=> ta thêm dd HCl vào cốc trái
gọi n NaHCO3 pư=b mol
+) NaHCo3+ HCl->NaCl + CO2 + H2O
b-> b-> b mol
m dd HCl 500b
m CO2=44b
-> m tăng 500b-44b=456b g
* NaHCO3 hết : m tăng 57,4 (ko thỏa mãn )
=> HCl hết
=> m cốc trái tăng =456b=9,4g => b =0,0206
=> m dd HCl =10,307 g
n NaHCO3=0,126 mol
n Al =0,74 mol
+) thêm vào cốc phải : gọi n AL pư =a mol
a-> 3a-> 1,5a
m dung dịch HCl thêm 3a.36,5/7,3%=1500a g
m H2 =3a
3a< 1500a
-> m cốc phải tăng lên luôn > m cốc trái
=> ta thêm dd HCl vào cốc trái
gọi n NaHCO3 pư=b mol
+) NaHCo3+ HCl->NaCl + CO2 + H2O
b-> b-> b mol
m dd HCl 500b
m CO2=44b
-> m tăng 500b-44b=456b g
* NaHCO3 hết : m tăng 57,4 (ko thỏa mãn )
=> HCl hết
=> m cốc trái tăng =456b=9,4g => b =0,0206
=> m dd HCl =10,307 g

a) a(g) vào cốc CaCO3 xảy ra phản ứng:
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
b(g) vào cốc Cu xảy ra phản ứng:
\(Cu+H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\)
- Ở cốc 1 khối lượng tăng lên là (56/100)a. Ở cốc b khối lượng không thay đổi nên không thể xác định tỉ lệ a/b
b) \(CaCO_3+H_2SO_4\rightarrow CaSO_4+CO_2+2H_2O\)Cu vào cốc 1 không phản ứng.
Ở cốc 2, khối lượng tăng lên là: (56/100)a(g), cốc 2 tăng lên b(g)
Để cân thăng bằng thì (56/1000a=b=>a/b=100/56

AlCl3 + 3NaOH=> 3NaCl + Al(OH)3
0,4--------->1,2------------------>0,4
NaOH + Al(OH)3 => NaAlO2 + 2H2O
0,3<------0,3
2Al(OH)3 => Al2O3 + 3H2O
0,1<-------------0,05
nAl2O3 = \(\frac{5,1}{102}=0,05mol\)
nAlCl3 = 0,2.2=0,4 mol
=> nNaOH = 1,2 + 0,3 = 1,5 mol
=>a = 1,5/0,2 = 7,5(M)

\(n_{Mg}=\dfrac{13.44}{24}=0.56\left(mol\right)\)
TN1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.56................................0.56\)
TN2 :
\(MCO_3+H_2SO_4\rightarrow MSO_4+CO_2+H_2O\)
\(x............................x\)
Vì cân thăng bằng nên :
\(m_{Mg}-m_{H_2}=m_{MCO_3}-m_{CO_2}\)
\(\Rightarrow13.44-0.56\cdot2=22-44x\)
\(\Rightarrow x=0.22\)
\(M_{MCO_3}=\dfrac{22}{0.22}=100\left(g\text{/}mol\right)\)
\(\Rightarrow M=100-60=40\left(g\text{/}mol\right)\)
\(M:Ca\)

a,
Khi trộn hai cốc lại với nhau xảy ra phản ứng :
\(Na_2CO_3+2HCl-->2NaCl+H_2O+CO_2\)
Vì có khí CO2 thoát ra nên tổng khối lượng giảm
\(=>\) Sau một thời gian chờ hỗn hợp phản ứng hoàn toàn \(=>m_B< m_A\)
b, Cho từ từ cốc HCl vào cốc Na2CO3 xảy ra phản ứng :
\(Na_2CO_3+HCl-->NaCl+NaHCO_3\)
Nếu NaCO3 dư thì không khí có thoát ra . Để lâu ngoài không khí xảy ra phản ứng :
\(Na_2CO_3+CO_2+H_2O-->2NaHCO_3\)
Do hấp thụ CO2 ngoài không khí nên lúc đó khối lượng mB tăng lên
\(->m_B>m_A\)
Vậy .....................
***Cốc A: AgNO3 + HCl = AgCl + HNO3(1)
mA = mAgNO3 + mHCl = 300
mdd(sau) = mAgNO3 + mHCl - mAgCl = 300 - mAgCl
***Cốc B: Na2CO3 + 2HCl = 2NaCl + CO2 + H2O(2)
mB = mdd(sau) = mNa2CO3 + mHCl - mCO2 = 300 - mCO2
Theo đề: phải thêm vào B 2,2 g cân trở lại cân bằng------->mCO2 = 2,2g---->nCO2 = 0,05mol
(2)--->nNa2CO3 = nCO2 = 0,05mol------->mNa2CO3 = 5,3g
--->%Na2CO3(trong dung dịch Na2CO3) = 5,3/100 = 5,3%
khối lượng dung dịch cốc B sau khi thêm HCl > khối lượng dung dịch cốc A là 12,25
------>mAgCl = 12,25 - mCO2 = 10,05---->nAgCl = 0,07mol
(1)---->nAgNO3 = nAgCl = 0,07mol ---->mAgNO3 = 11,9g
---->%AgNO3(trong dung dich AgNO3) = 11,9/100 = 11,9%
mk nên nghĩ bạn tự mk giải ra sẽ tốt hơn , coppy thế này thì.........