Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dùng quỳ tím ẩm:
+Hóa đỏ: \(HCl\)
+Hóa xanh: \(KOH\)
+Không đổi màu: \(NaCl;KBr;Ba\left(NO_3\right)_2\)
Dùng một lượng nhỏ \(AgNO_3\) cho vào mỗi mẫu:
+Xuất hiện kết tủa trắng: \(NaCl\)
\(AgNO_3+NaCl\rightarrow AgCl\downarrow+NaNO_3\)
+Xuất hiện kết tủa vàng nhạt: \(KBr\)
\(AgNO_3+KBr\rightarrow AgBr\downarrow+KNO_3\)
+Chất còn lại không phản ứng là \(Ba\left(NO_3\right)_2\)

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
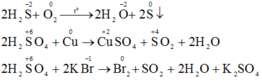

Đáp án C
A đúng. Khi thêm NO2 thì phản ứng chuyển dich theo chiều nghịch
B đúng. Khi giảm áp suất thì cân bằng chuyển dịch theo chiều tăng áp suất tức chiều số mol khí tăng -> KL mol giảm
C sai vì tăng nhiệt độ phản ứng chuyển dịch theo chiều thu nhiệt tức chiều thuận -> Số mol khí tăng -> KL mol giảm
D đúng vì giảm nhiệt độ phản ứng chuyển dịch theo chiều tỏa nhiệt tức chiều nghịch -> Màu nâu đỏ nhạt dần
Đáp án C

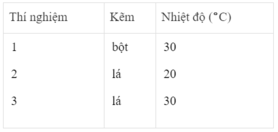
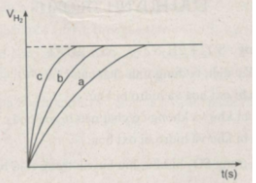
Nhận xét:
- Khí hiđro được giải phóng ở thí nghiệm 1 nhiều, nhanh hơn ở thí nghiệm 3. Vì diện tích tiếp xúc của Zn với H 2 SO 4 ở thí nghiệm 1 lớn hơn. trong khi đó nhiệt độ của dung dịch axit là như nhau.
- Khí hiđro được giải phóng ở thí nghiệm 3 nhiều, nhanh hơn ở thí nghiệm 2. Vì nhiệt độ của dung dịch H 2 SO 4 ở thí nghiệm 3 cao hơn, trong khi đó diện tích tiếp xúc giữa Zn và axit là như nhau.

a)H2S chỉ thể hiện tính khử vì số oxi hóa của S ở mức thấp nhất :-2 .(Không thể giảm nên chỉ có tình khử)
H2SO4 chỉ thể hiện tính oxi hóa vì số oxi hóa của S ở mức cao nhất :6 . (Không thể tăng nên chỉ có tính oxi hóa)
b)H2S + Pb(NO3)2-->PbS + 2HNO3
H2SO4+ FeS -->H2S + FeSO4

A đúng. Khi thêm NO2 thì phản ứng chuyển dịch theo chiều nghịch
B đúng. Khi giảm áp suất thì cân bằng chuyển dịch theo chiều tăng áp suất tức chiều số mol khí tăng
→ KL mol giảm
C sai vì tăng nhiệt độ phản ứng chuyển dịch theo chiều thu nhiệt tức chiều thuận → Số mol khí tăng
→ KL mol giảm
D đúng vì giảm nhiệt độ phản ứng chuyển dịch theo chiều tỏa nhiệt tức chiều nghịch → Màu nâu đỏ nhạt dần
Đáp án C

A sai vì giảm SO3 cân bằng chuyển dịch theo chiều tăng SO2 là chiều thuận
B sai vì tăng nhiệt độ cân bằng chuyển dịch theo chiều thu nhiệt là chiều nghịch
C sai vì khi giảm áp suất cân bằng chuyển dịch theo chiều làm tăng áp suất là chiều nghịch
D đúng
Đáp án D

Đáp án D
A sai vì giảm SO3 cân bằng chuyển dịch theo chiều tăng SO2 là chiều thuận
B sai vì tăng nhiệt độ cân bằng chuyển dịch theo chiều thu nhiệt là chiều nghịch
C sai vì khi giảm áp suất cân bằng chuyển dịch theo chiều làm tăng áp suất là chiều nghịch
D đúng
Đáp án D
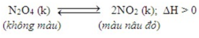
Em quan sát hiện tượng của phản ứng
- Chất tham gia thay đổi như thế nào (VD: chất rắn bị tan dần trong dung dịch,..)
- Sản phẩm (màu sắc của chất kết tủa, màu/mùi của chất khí, sự thay đổi màu sắc của dung dịch trước và sau phản ứng,..)
- Nếu cho sơ đồ thí nghiệm thì em cần biết vai trò của các vật dụng/hoá chất trong thí nghiệm. (VD: dung dịch H2SO4 có tác dụng hút nước, làm khô chất sản phẩm,..)