Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: Fe + CuSO4 --> FeSO4 + Cu
______a------------------------------>a
=> 64a - 56a = 0,2
=> 0,025 (mol)
=> mFe(pư) = 0,025.56 = 1,4 (g)
=> mCu = 0,025.64 = 1,6 (g)

Đặt nFe(pứ)=a(mol)
PTHH Fe +CuSO4------>FeSO4+Cu
Theo phương trình =>nFe=nCu=a(mol)
mđinh sắt tăng=mcu-mFe=64a-56a=0,2(g)
=>a=0,025(mol)
=>mFe(pứ)=0,025.56=1,4(g)
mCu=0,025.64=1,6(g)

Đáp án B.
Fe + CuSO 4 → FeSO 4 + Cu
1 mol Fe sau phản ứng tạo 1 mol Cu khối lượng tăng lên 8g
0,1 mol Fe sau phản ứng tạo 0,1 mol Cu khối lượng tăng lên 0,8g
m FeSO 4 = 0,1 x 152 = 15,2g

\(n_{Fe}=a\left(mol\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
\(a............................a\)
\(m_{tăng}=m_{Cu}-m_{Fe}=64a-56a=51-50=1\left(g\right)\)
\(\Rightarrow a=0.125\left(mol\right)\)
\(m_{Fe}=0.125\cdot56=7\left(g\right)\)
\(m_{Cu}=0.125\cdot64=8\left(g\right)\)
\(m_{Fe\left(dư\right)}=50-7=43\left(g\right)\)

Khối lượng dung dịch CuSO 4 : m dd CuSO 4 = 1,12 x 50 = 56 (gam).
CuSO 4 + Fe → FeSO 4 + Cu
64x — 56x = 5,16 - 5 = 0,16 (gam) => x = 0,02 mol.
m CuSO 4 tham gia phản ứng = 0,02 x 160 = 3,2 (gam);
100 gam dung dịch CuSO 4 có 15 gam CuSO 4 nguyên chất.
56 gam dung dịch CuSO 4 có X gam CuSO 4 nguyên chất.
x = 56 x 15/100 = 8,4g; m CuSO 4 còn lại = 8,4 - 3,2 = 5,2g
m FeSO 4 = 0,02 x 152 = 3,04g
m dd sau p / u = 56 - 0,16 = 55,84g
C % CuSO 4 = 5,2/55,84 x 100% = 9,31%
C % FeSO 4 = 3,04/55,84 x 100% = 5,44%

Gọi a là số mol C u S O 4 tham gia phản ứng
Phương trình hóa học:
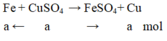
Theo đề bài ta có: m C u b á m v à o – m F e tan r a = m K L t ă n g
64a – 56a = 0,8 ⇒ a = 0,01 mol
Nồng độ dung dịch C u S O 4 là: C M = n V = 0,01 0,2 = 0,5 M
⇒ Chọn C.

\(n_{CuSO_4}=\dfrac{40.20}{100}:160=0,05\left(mol\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
x x x x
Gọi x là số mol Fe pứ.
có: \(64x-56x=4,5-4,2=0,3\)
<=> 8x = 0,3
=> x = 0,0375
=> \(n_{Fe\left(pứ\right)}=n_{CuSO_{4\left(pứ\right)}}=n_{FeSO_{4\left(pứ\right)}}=x=0,0375\left(mol\right)\)
Vì: \(\dfrac{0,0375}{1}< \dfrac{0,05}{1}\) nên dd \(CuSO_4\) dư sau pứ là: \(0,05-0,0375=0,0125\left(mol\right)\)
Có: \(m_{dd}=4,2+40-4,5=39,7\left(g\right)\)
\(C\%_{dd.CuSO_{4\left(sau.pứ\right)}}=\dfrac{0,0125.160.100}{39,7}=5,04\%\)
\(C\%_{dd.FeSO_4}=\dfrac{0,0375.152.100}{39,7}=14,36\%\)

Fe + CuSO4 = FeSO4 + Cu
Sau phản ứng khối lượng thanh sắt tăng lên, chứng tỏ có 1 lượng Cu bám lên thanh sắt.
Khối lượng Cu phản ứng là: 16,4 - 15,6 = 0,8 (g)
Số mol Cu là: 0,8 : 64 = 0,0125 (mol)
Theo PTHH: n Fe= nCu = 0,0125 (mol)
Khối lượng sắt tham gia phản ứng là: 0,0125 x 56 = 0,7(g)
Tham khảo:
PTHH: Fe + CuSo4 ---->FeSo4 + Cu
Gọi a(mol) là số mol của Fe phản ứng
mCu - mFe = 3.5 - 2.3 = 1.2(g)
<--> 64a - 56a = 1.2
<--> 8a = 1.2
<--> a = 0.15
Dựa vào PTHH: nFe = nFeSo4 = 0.15(mol)
--> mFeSo4 = 0.15×152 = 22.8(g)