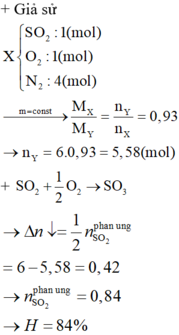Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

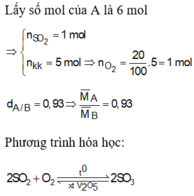
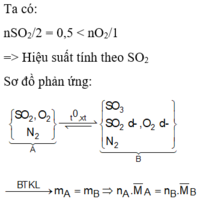
dX/H2 = 24 => trong hỗn hợp khí X , nSO2 = nO2
Đặt nSO2 = nO2 = a mol
2SO2 + O2 -> 2SO3
Đặt nO2 phản ứng = b mol
Sau phản ứng, hỗn hợp Y gồm a-2b mol SO2 , a-b mol O2 và 2b mol SO3 dY/H2 = 30 <=> 64(a-2b)+32(a-b)+80.2b=2.30.(2a-b) => a=5/2b
Phần trăm số mol của O2 trong hỗn hợp Y là: (a-b)/(2a-b) = 37,5%
Đáp án D

a) Khí A có khối lượng = 0,25.64 = 16; Gọi A có công thức CxHy, vì C chiếm 75% nên 12x/y = 75/25 ---> x/y = 1/4.
Vậy A có CTHH: CH4 (metan).

a) MA= 64 . 0,25 = 16 g/mol
gọi CTC của A là CxHy
Ta có : \(\frac{12x}{y}=\frac{75\%}{25\%}\)=> \(\frac{x}{y}=\frac{75}{25.12}=\frac{75}{300}=\frac{1}{4}\)
CTHH : CH4

Đáp án C
A đúng. Khi tăng nhiệt độ thì thấy tỉ khối của hỗn hợp khí so với hidro giảm chứng tỏ số mol khí tăng lên (vì tổng khối lượng không đổi) →Cân bằng chuyển dịch theo chiều nghịch
→Phản ứng nghịch thu nhiệt, phản ứng thuận tỏa nhiệt.
B đúng. Giải thích như ý A.
C sai. Khi tăng nhiệt độ tốc độ phản ứng thuận và nghịch đều tăng, phản ứng nhanh đạt trạng thái cân bằng và cân bằng chuyển dịch theo chiều nghịch.
D đúng. Khi tăng áp suất cân bằng chuyển dịch theo chiều thuận để làm giảm số mol khí, giảm áp suất chung của hệ.

Chọn đáp án C
Sử dụng sơ đồ đường chéo ⇒ nO2:nO3 = 5:3
+ Giả sử nCO2 6 mol và nH2O = 7 mol ta có sơ đồ.
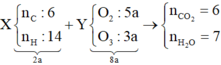
+ Bảo toàn Oxi ⇒ 2nO2 + 3nO3 = 5x2a + 3x3a = 2nCO2 + nH2O = 6x2 + 7 = 19 ⇒ a = 1
![]()
⇒ Chọn C