Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thể tích của dung dịch bari clorua
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{240}{1,20}=200\left(ml\right)\)
200ml = 0,2l
Số mol của dung dịch bari clorua
CMBaCl2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,2=0,2\left(mol\right)\)
Khối lượng của muối natri sunfat
C0/0Na2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{14,2.400}{100}=56,8\left(g\right)\)
Số mol của muối natri sunfat
nNa2SO4 = \(\dfrac{m_{Na2SO4}}{M_{Na2SO4}}=\dfrac{56,8}{142}=0,4\left(mol\right)\)
Pt : BaCl2 + Na2SO4 → BaSO4 + 2NaCl\(|\)
1 1 1 2
0,2 0,4 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,4}{1}\)
⇒ BaCl2 phản ứng hết , Na2SO4 dư
⇒ Tính toán dựa vào số mol BaCl2
Số mol của dung dịch bari sunfat
nBaSO4 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của dung dịch bari sunfat
mBaSO4 = nBaSO4 . MBaSO4
= 0,2 . 233
= 46,6 (g)
Số mol dư của dung dịch natri sunfat
ndư = nban đầu - nmol
= 0,4 - (0,2 . 1)
= 0,2 (mol)
Khối lượng dư của dung dịch natri sunfat
mdư = ndư . MNa2SO4
= 0,2 . 142
= 28,4 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mBaCl2 + mNa2SO4 - mBaSO4
= 240 + 400 - 46,6
= 593,4 (g)
Nồng độ phần trăm của dung dịch bari sunfat
C0/0BaSO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{46,6.100}{593,4}=7,85\)0/0
Nồng độ phần trăm của dung dịch Natri sunfat
C0/0Na2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{28,4.100}{593,4}=4,78\)0/0
Chúc bạn học tốt

m Mg = 4,8 g => n Mg = 0,2 mol
Mg + H2SO4 -> MgSO4 + H2
0,2 0,2 0,2
=> m H2SO4 = 0,2 . 98 = 19,6g
=> m dd H2SO4 = \(\frac{19,6.100\%}{24,5\%}=80g\)
m dd sau pứ = m dd H2SO4 = 80g
=> C% dd muối = \(\frac{0,2.120.100\%}{80}\)= 30%
#mã mã#

a)\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
b)Số mol của kẽm là:
\(n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\)
\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
tỉ lệ : 1 1 1 1 (mol)
số mol : 0,15 0,15 0,15 0,15 (mol)
Khối lượng H2SO4 tham gia phản ứng là:
\(m_{H_2SO_4}=0,15.98=14,7\left(g\right)\)
c)Khối lượng của dung dịch H2SO4 là:
\(m_{ddH_2SO_4}=D.V_{dd}=500.1,2=600\left(g\right)\)
Nồng độ phần trăm của dung dịch H2SO4 là:
\(C_{\%H_2SO_4}=\dfrac{m_{H_2SO_4}}{m_{ddH_2SO_4}}.100\%=\dfrac{14,7}{600}.100\%=2,45\%\)
d) Khối lượng của khí H2 là:
\(m_{H_2}=0,15.2=0,3\left(g\right)\)
Khối lượng của ZnSO4 là:
\(m_{ZnSO_4}=0,15.161=24,15\left(g\right)\)
Khối lượng của dung dịch ZnSO4 là:
\(m_{ddZnSO_4}=9,75+600-0,3=609,45\left(g\right)\)
Nồng độ dung dịch của muối sau phản ứng là:
\(C_{\%ZnSO_4}=\dfrac{m_{ZnSO_{\text{4}}}}{m_{ddZnSO_4}}.100\%=\dfrac{24,15}{609,45}.100\%=3,9\%\)

Gọi x,y lần lượt là số mol của MgO, Fe3O4
Pt: MgO + H2SO4 --> MgSO4 + H2O
.......x............x..................x
......Fe3O4 + 4H2SO4 --> Fe2(SO4)3 + FeSO4 + 4H2O
.........y................4y..................y................y
Ta có hệ pt: \(\left\{{}\begin{matrix}40x+232y=35,84\\120x+552y=90,24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,12\end{matrix}\right.\)
mMgO = 0,2 . 40 = 8 (g)
mFe3O4 = 35,84 - 8 = 27,84 (g)
nH2SO4 = x + 4y = 0,2 + 4 . 0,12 = 0,68 mol
mdd H2SO4 = \(\dfrac{0,68\times98}{9,8}.100=680\left(g\right)\)
mdd sau pứ = mhh + mdd H2SO4 = 35,84 + 680 = 715,84 (g)
C% dd MgSO4 = \(\dfrac{0,2.120}{715,84}.100\%=3,35\%\)
C% dd FeSO4 = \(\dfrac{0,12.152}{715,84}.100\%=2,548\%\)
C% dd Fe2(SO4)3 = \(\dfrac{0,12.400}{715,84}.100\%=6,705\%\)

PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
a) Ta có: \(n_{BaCl_2}=\frac{20,8}{208}=0,1\left(mol\right)\) \(\Rightarrow n_{H_2SO_4}=0,1mol\)
\(\Rightarrow m_{H_2SO_4}=98\cdot0,1=9,8\left(g\right)\) \(\Rightarrow m_{ddH_2SO_4}=\frac{9,8}{9,8\%}=100\left(g\right)\)
b) Theo PTHH: \(n_{BaCl_2}=n_{BaSO_4}=0,1mol\)
\(\Rightarrow m_{BaSO_4}=0,1\cdot233=23,3\left(g\right)\)
c) Theo PTHH: \(n_{BaCl_2}:n_{HCl}=1:2\) \(\Rightarrow n_{HCl}=0,2mol\)
\(\Rightarrow m_{HCl}=0,2\cdot36,5=7,3\left(g\right)\)
Ta có: \(m_{dd}=m_{BaCl_2}+m_{ddH_2SO_4}-m_{BaSO_4}=20,8+100-23,3=97,5\left(g\right)\) \(\Rightarrow C\%_{HCl}=\frac{7,3}{97,5}\cdot100\approx7,49\%\)
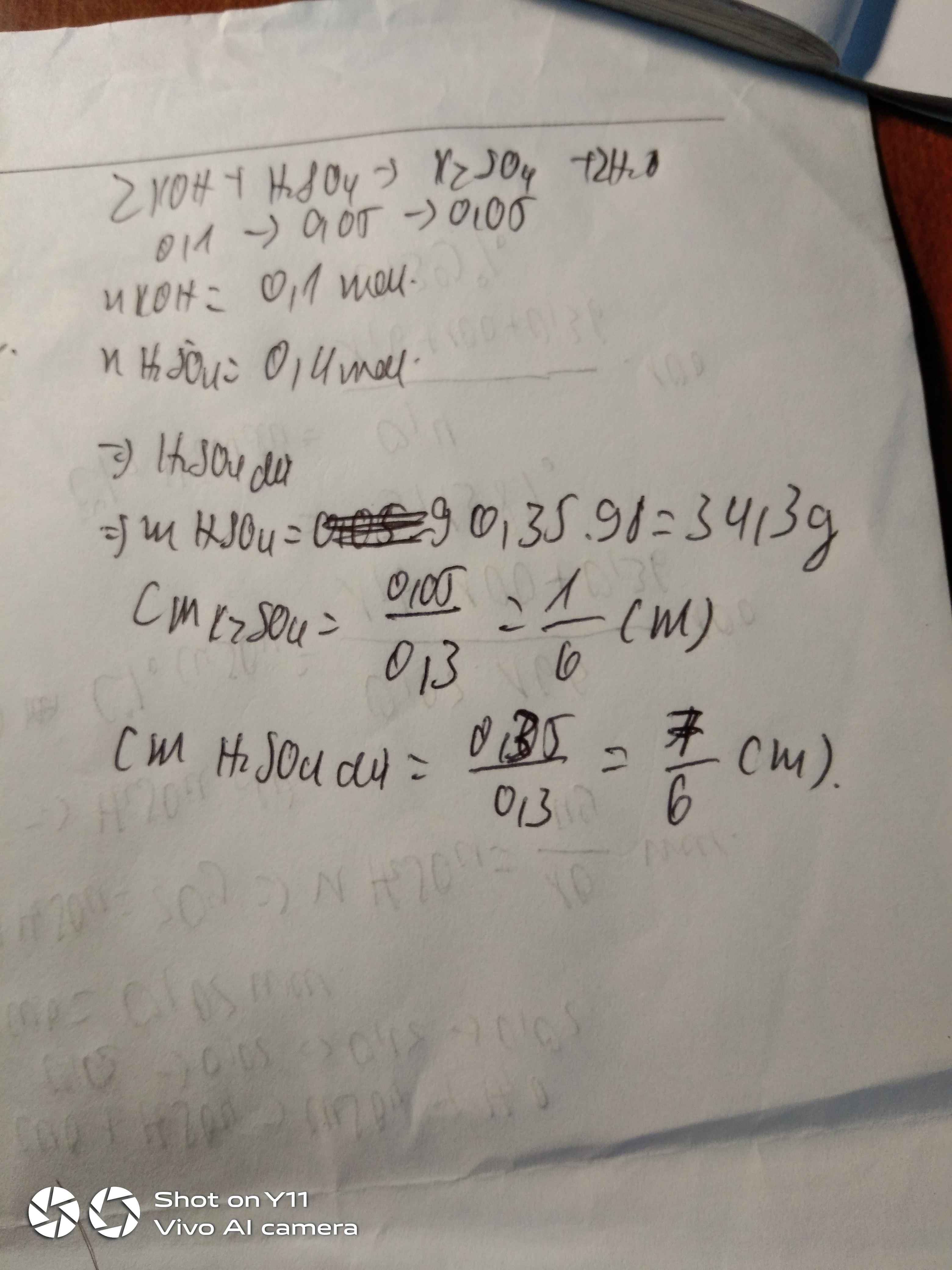
ptpu : Mg+H2SO4 ---> MgSO4 + H2 (1)
a) nMg=4,8/24= 0,2 (mol)
từ (1)=> n h2so4 =n mg = nmg2so4=nh2= 0,2 (mol)
=> mddH2SO4 = 0,2x98/0,245= 80(g)
m dd sau pư= 80+4,8-0,2x2=84,4(g)
m MgSO4= 0,2x(24+96)= 24(g)
=> C%MgSO4=24/84,4x100=28,43%
b) v dung dịch sau pư = 84,4/1,2=70(ml)
CMmgso4= n/v
T Số = 0,2/0,07= 2,86 M