Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 2:
Cu +HCl không pư
Mg +2HCl → MgCl2 + H2
x x x
2Al +6 HCl →2AlCl3 +3 H2
y y 3/2y
Vì Cu không pư ⇒mCu=2,54 (g)⇒mMg,Al=6,6 (g)
nH2= 0,32 (mol)
Đặt x=nMg , y=nAl
Theo PTHH ta có:
24x + 27y =6,6
x + 3/2y =0,32
⇔ x=0,14
y=0,12
mMgCl2=13,3 (g)
mAlCl3=12,78 (g)
⇒m=13,3 + 12,78 =26,08 (g)
Bài 3:mcrăn = mKLmKL + mOmO
2 H + O -> H2OH2O
mol 0.8 0.4
mcrắn = 40 + 0,4 .16 = 46,4 gam
Bài 4:
Fe+H2SO4=FeSO4+H2
nH2=1,792/22,4=0,08mol
=>nFe=0,08mol
Khi cho 0,08mol Fe td với HNO3:
Quá trình nhường e: Fe=Fe+3 +3e
=> n e nhường=0,24mol
Theo ĐLBTe, ta có n e cho=n e nhận.
Quá trình nhận e: N+5 +3e=>N+2
=> nN+2=0,24/3=0,08mol
=>nNO=0,08mol =>V NO=0,08.22,4=1,792l
Bổ sung câu 1 : Cách 2
Ta có:
\(n_{H2}=\frac{8,52}{22,4}=0,38\left(mol\right)\)
\(2n_{Mg}+27n_{Al}=7,68\left(1\right)\)
Bảo toàn e:
\(2n_{Mg}+3n_{Al}=2n_{H2}=0,76\left(2\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,14\left(mol\right)\\n_{Al}=0,16\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Al}=\frac{0,16.27}{7,68}.100\%=56,25\%\)

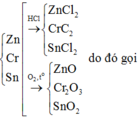
Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)
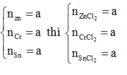


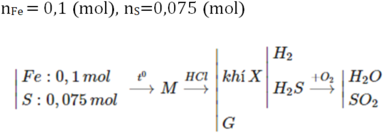

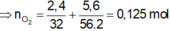


$n_{HCl}=0,2.2=0,4(mol)$
BTNT(H): $n_{H_2O}=0,5n_{HCl}=0,2(mol)$
BTNT(O): $n_{O(\text{trong oxit})}=n_{H_2O}=0,2(mol)$
$\to m_X=0,2.16+20=23,2(g)$
$\to A$
\(m_{rắn}=m_{kl}+m_O\\ n_{HCl}=0,2.2=0,4\left(mol\right)\Rightarrow n_O=n_{H_2O}=\dfrac{n_{HCl}}{2}=\dfrac{0,4}{2}=0,2\left(mol\right)\\ m_{rắn}=20+0,2.16=23,2\left(g\right)\\ \Rightarrow Chọn.A\)