Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a.n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ Đặt:\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ \rightarrow\left\{{}\begin{matrix}27a+24b=5,1\\1,5a+b=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \left\{{}\begin{matrix}\%m_{Al}=\dfrac{27.0,1}{5,1}.100\approx52,941\%\\\%m_{Mg}\approx47,059\%\end{matrix}\right.\)
\(b.m_{ddH_2SO_4}=\dfrac{0,25.98.100}{9,8}=250\left(g\right)\\ m_{ddsau}=m_{Al,Mg}+m_{ddH_2SO_4}-m_{H_2}=5,1+250-0,25.2=254,6\left(g\right)\\ C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342}{254,6}.100\approx6,716\%\\ C\%_{ddMgSO_4}=\dfrac{0,1.120}{254,6}.100\approx4,713\%\)

a, PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{14,8}.100\%\approx72,97\%\\\%m_{MgO}\approx27,03\%\end{matrix}\right.\)
b, Ta có: \(n_{MgO}=\dfrac{14,8-0,4.27}{40}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{H_2}+n_{MgO}=0,7\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,7.98=68,6\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{68,6}{10\%}=686\left(g\right)\)
c, Theo PT: \(\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,2\left(mol\right)\\n_{MgSO_4}=n_{MgO}=0,1\left(mol\right)\end{matrix}\right.\)
Ta có: m dd sau pư = 14,8 + 686 - 0,6.2 = 699,6 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,2.342}{699,6}.100\%\approx9,78\%\\C\%_{MgSO_4}=\dfrac{0,1.120}{699,6}.100\%\approx1,72\%\end{matrix}\right.\)

a) PTHH : \(Zn+H_2SO_4-->ZnSO_4+H_2\uparrow\) (1)
\(ZnO+H_2SO_4-->ZnSO_4+H_2O\) (2)
b) Theo pthh (1) : \(n_{Zn}=n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(m_{Zn}=0,1.65=6,5\left(g\right)\)
=> \(m_{ZnO}=22,7-6,5=16,2\left(g\right)\)
c) \(ZnO=\dfrac{16,2}{81}=0,2\left(mol\right)\)
Theo pthh (1) và (2) : \(\Sigma n_{H2SO4}=n_{Zn}+n_{ZnO}=0,1+0,2=0,3\left(mol\right)\)
=> \(C_{M\left(ddH2SO4\right)}=\dfrac{0,3}{0,1}=1,5M\)
a) PTHH : Zn+H2SO4−−>ZnSO4+H2↑Zn+H2SO4−−>ZnSO4+H2↑ (1)
ZnO+H2SO4−−>ZnSO4+H2OZnO+H2SO4−−>ZnSO4+H2O (2)
b) Theo pthh (1) : nZn=nH2=2,2422,4=0,1(mol)nZn=nH2=2,2422,4=0,1(mol)
=> mZn=0,1.65=6,5(g)mZn=0,1.65=6,5(g)
=> mZnO=22,7−6,5=16,2(g)mZnO=22,7−6,5=16,2(g)
c) ZnO=16,281=0,2(mol)ZnO=16,281=0,2(mol)
Theo pthh (1) và (2) : ΣnH2SO4=nZn+nZnO=0,1+0,2=0,3(mol)ΣnH2SO4=nZn+nZnO=0,1+0,2=0,3(mol)
=> CM(ddH2SO4)=0,30,1=1,5M
tích đúng đê

nH2 = 2,24 : 22,4 = 0,1 mol
gọi x , y lần lượt là số mol Mg và MgO
PTHH : Mg + H2SO4 → MgSO4 + H2
0,1 mol 0,1 mol 0,1 mol
=> mMg = 0,1 . 24 = 2,4 g
%mMg = \(\frac{2,4.100\%}{10,4}=23,08\text{%}\)
Ta có : mhh = mMg + mMgO
=> mMgO = 10,4 - 2,4 = 8g
=> nMgO = 8 : 40 = 0,2 mol
%mMgO = \(\frac{8.100\%}{10,4}=76,92\%\)
MgO + H2SO4 → MgSO4 + H2O
0,2 mol 0,2 mol
Số mol H2SO4 là : nH2SO4 = 0,1 + 0,2 = 0,3 mol
Nồng độ mol dd H2SO4 là
CM H2SO4 = \(\frac{0,3}{0,3}=1M\)
nH2 = 2,24 : 22,4 = 0,1 mol
PTHH : Mg + H2SO4 → MgSO4 + H2
0,1 mol 0,1 mol 0,1 mol
=> mMg = 0,1 . 24 = 2,4 g
%mMg = 2,4.100%10,4=23,08%2,4.100%10,4=23,08%
Ta có : mhh = mMg + mMgO
=> mMgO = 10,4 - 2,4 = 8g
=> nMgO = 8 : 40 = 0,2 mol
%mMgO = 8.100%10,4=76,92%8.100%10,4=76,92%
MgO + H2SO4 → MgSO4 + H2O
0,2 mol 0,2 mol
Số mol H2SO4 là : nH2SO4 = 0,1 + 0,2 = 0,3 mol
Nồng độ mol dd H2SO4 là
CM H2SO4 = 0,3.0,3=1M
#Không có gọi x,y nảy viết nhầm

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol)\\ Mg+H_2SO_4\to MgSO_4+H_2\\ MgO+H_2SO_4\to MgSO_4+H_2O\\ \Rightarrow n_{Mg}=0,25(mol)\\ a,\begin{cases} \%_{Mg}=\dfrac{0,25.24}{14}.100\%=42,86\%\\ \%_{MgO}=100\%-42,86\%=57,14\% \end{cases}\\ b,n_{MgO}=\dfrac{14-0,25.24}{40}=0,2(mol)\\ \Rightarrow \Sigma n_{H_2SO_4}=0,2+0,25=0,45(mol)\\ \Rightarrow C\%_{H_2SO_4}=\dfrac{0,45.98}{200}.100\%=22,05\%\)

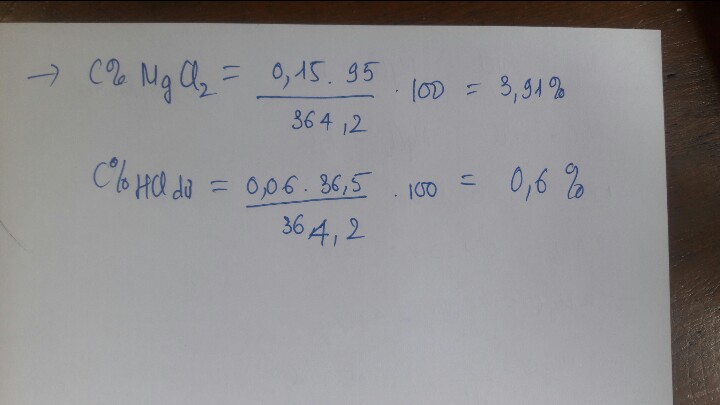
a) Mg +H2SO4 --> MgSO4 +H2 (1)
MgO +H2SO4 --> MgSO4 +H2O (2)
nH2=0,1(mol)
=>nMg=0,1(Mol)
=>mMg=2,4(g)
mMgO=8(g)
=>%mMg=23,077(%)
%mMgO=76,92(%)
b) nMgO=0,2(mol)
theo (1) :nH2SO4=nMgSO4=nMg=0,1(mol)
(2) : nH2SO4=nMgSO4=nMgO=0,2(mol)
=> nMgSO4=0,3(mol)
=> CM ddMgSO4=1(M)
=>\(\Sigma nH2SO4=0,3\left(mol\right)\)
=>mdd H2SO4=300(g)
mdd MgSO4=10,4+300-0,1.2=310,2(g)
=>DddA=310,2/300=1,034(g/ml)