Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

b1
cho m gam hỗn hợp gồm Zn và S vào bình không có không khí ,nung bình sau một thời gian thu được chất
b2
Fe+Sto→FeS
Ta có: nFe=5,6\56=0,1 mol; nS=3,2\32=0,1 moln
VÌ số mol hai chất bằng nhau theo đúng tỉ lệ phản ứng nên tính hiệu suất theo chất nào cũng được.
Gọi số mol Fe phản ứng là x
→nFeS=nFe phản ứng=x mol; nFe dư=0,1−x mol\
FeS+2HCl→FeCl2+H2S\
Fe+2HCl→FeCl2+H2\
→nH2S=nFeS=x mol; nH2=nFe dư=0,1−x mol\
→nY=x+0,1−x=0,1 mol; mY=34.x+2.(0,1−x)=0,1.10,6.2→x=0,06 mol
Hiệu suất phản ứng: H=0,06\0,1=60%

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Nồng độ mol của dung dịch HCL :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl : 0,2125/0,5 = 0,425 (mol/l)

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H 2 S
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H 2 S và 50% khí H 2

Đáp án A
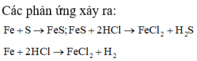
Hỗn hợp khí Z gồm H2S và H2. Đặt nFe=1mol . Dựa vào phương trình phản ứng ta thấy vì số mol khí sinh ra luôn là 1 mol với bất kì hiệu suất và tỉ lệ a:b nào nên:
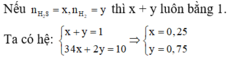
Theo đề bài hiệu suất phản ứng là 50% nhưng do chưa biết Fe hay S dư nên phải xét hai trường hợp. Tuy nhiên khi nhìn vào đáp án có thể thấy số mol sắt lớn hơn số mol lưu huỳnh nên hiệu suất được tính theo lưu huỳnh. Bảo toàn lưu huỳnh suy ra
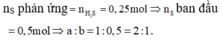

Đáp án A
Các phản ứng xảy ra:
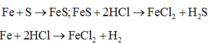
Hỗn hợp khí Z gồm H2S và H2. Đặt nFe=1mol . Dựa vào phương trình phản ứng ta thấy vì số mol khí sinh ra luôn là 1 mol với bất kì hiệu suất và tỉ lệ a:b nào nên:
Nếu ![]() thì x + y luôn bằng 1. Ta có hệ:
thì x + y luôn bằng 1. Ta có hệ:
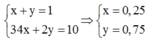
Theo đề bài hiệu suất phản ứng là 50% nhưng do chưa biết Fe hay S dư nên phải xét hai trường hợp. Tuy nhiên khi nhìn vào đáp án có thể thấy số mol sắt lớn hơn số mol lưu huỳnh nên hiệu suất được tính theo lưu huỳnh. Bảo toàn lưu huỳnh suy ra
nS phản ứng
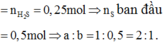

- tìm m:
TH1: S hết ➝ nH2S = 0,1
mà nY = 0,12 ➝ nH2 = 0,02
➩ nFe = nH2 + nH2S = 0,12 SUY RA m = 6,72g
TH2 : S dư
➝ nH2S = 0,12 > nS = 0,1 SUY RA loại
- tìm hiệu suất:
dY/H2 = 9 ➝ My = 18
sơ đồ đường chéo: H2S 34 16
18 ➩ tỉ lệ nH2S / nH2 = 1/1
H2 2 16
nH2S = nH2 = 0,06 ➝ nS phản ứng = 0,06
Fe + S ➜ FeS
nếu pu này hoàn toàn thì S hết và Fe dư ( nS = 0,1; nFe = 0,12)
➩ %H = \(\dfrac{n_{Spứng}}{n_{Sbđ}}\). 100% = 60%

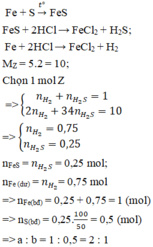
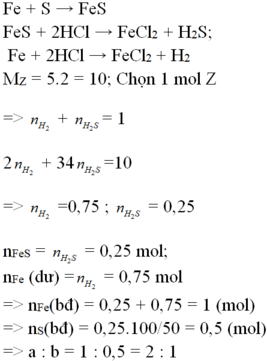
bạn giải cụ thể giúp mình được không
1.Chi tiết câu hỏi: Nung hỗn hợp X gồm Zn và S ở nhiệt độ cao thu đư | BigSchool.vn
2.
Câu 2: Nung hỗn hợp gồm 5,6 gam bột Fe và 4,0 gam bột S ở nhiệt độ cao thu được chất rắn X. Cho X vào dung dịch HCl dư, khí thoát ra có tỷ khối so với H2 là 13,8 . Vậy hiệu suất của phản ứng giữa sắt và lưu huỳnh là:
A. 65% B. 80% C. 70% D. 75%