Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Trong phân tử NH3: độ âm điện của H và N lần lượt là 2,2 và 3,0
⟹ Nguyên tử N hút electron liên kết mạnh hơn H gấp 3,0 : 2,2 = 1,36 lần.
- Trong phân tử H2O: độ âm điện của H và O lần lượt là 2,2 và 3,4
⟹ Nguyên tử O hút electron liên kết mạnh hơn H gấp 3,4 : 2,2 = 1,54 lần.
Vậy cặp electron liên kết trong phân tử H2O bị lệch nhiều hơn trong phân tử H2O.

- Phân tử H2 được tạo bởi 2 nguyên tử H, đều có độ âm điện là 2,2.
- Như vậy lực hút electron của 2 nguyên tử H bằng nhau. Vậy trong phân tử H2 cặp electron sẽ không bị lệch về nguyên tử nào.

- Trong phân tử HCl, Cl có độ âm điện lớn hơn H => Cặp electron chung lệch về phía nguyên tử Cl
- Trong phân tử NH3, N có độ âm điện lớn hơn H => Cặp electron chung lệch về phía nguyên tử N
- Trong phân tử CO2, O có độ âm điện lớn hơn C => Cặp electron chung lệch về phía nguyên tử O

vì X2Y3 có 50e => 2Zx + 3Zy = 50
lại có Zx nhiều hơn Zy 5e => Zx = 13, Zy = 8
=> X:Al, Y:O
cấu hình e X: 1s22s22p63s23p1.
cấu hình e Y: 1s22s22p4

Na2O, MgO, Al2O3
SiO2, P2O5, SO3
Cl2O7
∆X
2,51 2,13 1,83
( Liên kết ion )
1,54 1,25 0,86
( Liên kết cộng hóa trị có cực)
0,28
(Liên kết cộng hóa trị không cực)

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
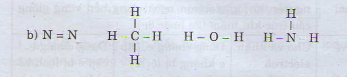
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

H2O có khối lượng phân tử thấp hơn so với C2H5OH nhưng các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
⟹ Nhiệt độ sôi của nước cao hơn C2H5OH.
⟹ Khi chưng cất rượu, C2H5OH có điểm sôi thấp hơn nước sẽ bay hơi trước.

1. Để giải thích cấu trúc hình học của phân tử H2O, thuyết lai hóa cho rằng nguyên tử O ở trạng thái lai hóa tứ diện sp3.
Sự hình thành các liên kết trong phân tử H2O được giải thích như sau:
Hai obitan lai hóa chứa electron độc thân sẽ xen phủ với 2 obitan 1s của 2 nguyên tử H tạo thành 2 liên kết .
Hai obitan lai hóa chứa cặp electron của O không tham gia liên kết hướng về hai đỉnh của hình tứ diện.
2. Do 2 cặp electron không liên kết trên nguyên tử O chỉ chịu lực hút của hạt nhân nguyên tử O nên 2 cặp electron này chiếm vùng không gian rộng hơn so với 2 cặp electron liên kết (chịu lực hút của hai hạt nhân). Do vậy nó tạo ra lực đẩy đối với đám mây các cặp electron liên kết, làm các đám mây này hơi bị ép lại, do vậy góc liên kết thực tế là 104,50 nhỏ hơn so với góc của tứ diện đều.
- Trong phân tử NH3: độ âm điện của H và N lần lượt là 2,2 và 3,0
⟹ Nguyên tử N hút electron liên kết mạnh hơn H gấp 3,0 : 2,2 = 1,36 lần.
- Trong phân tử H2O: độ âm điện của H và O lần lượt là 2,2 và 3,4
⟹ Nguyên tử O hút electron liên kết mạnh hơn H gấp 3,4 : 2,2 = 1,54 lần.
Vậy cặp electron liên kết trong phân tử H2O bị lệch nhiều hơn trong phân tử H2O.