Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hiện tượng :
- Viên kẽm tan dần trong dd HCl loãng, có khí không màu thoát ra.
- Dấu hiệu chứng tỏ có phản ứng hoá học giữa HCl và Zn là mẩu Zn tan dần, có khí thoát ra.

- Phản ứng ở ống nghiệm (2) xảy ra nhanh hơn.
- Khi tăng nồng độ chất tham gia phản ứng thì tốc độ phản ứng tăng.

PTHH: Na2CO3 + CaCl2 -> CaCO3 (kết tủa trắng) + 2NaCl
Hiện tượng: Có kết tủa trắng sau phản ứng.
Giải thích: Na2CO3 tác dụng với CaCl2 tạo muối CaCO3 không tan (kt trắng) và dd NaCl.

a, Đá vôi dạng bột tan nhanh hơn mẩu đá vôi nhỏ
b, Đá vôi dạng bột có diện tích bề mặt tiếp xúc với dd HCl nhiều hơn => Độ tan, phản ứng tan của đá vôi dạng bột nhanh hơn.
a) Đá vôi dạng bột (trong ống nghiệm 1) tan nhanh hơn đá vôi dạng viên (trong ống nghiệm 2).
b) Dựa vào tốc độ tan của đá vôi trong dung dịch acid để kết luận phản ứng nào xảy ra nhanh hơn.

PTHH: Cu + 2AgNO3 -> Cu(NO3)2 + 2Ag
Hiện tượng: Miếng đồng dần tan, có kết tủa trắng bạc bám lên dây đồng, dung dịch sau phản ứng có màu xanh lam nhạt.
Giải thích: Cu có tính khử mạnh hơn Ag nên đã đẩy kim loại Ag trong AgNO3 và tạo thành muối Cu(NO3)2 (dung dịch muối màu xanh lam nhạt), Ag bị đẩy ra có màu sáng bạc bám lên dây đồng.

a) Dần xuất hiện kết tủa trắng.
\(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgNO_3\)
\(b)n_{CaCl_2}=\dfrac{2,22}{111}=0,02mol\\ n_{AgNO_3}=\dfrac{1,7}{170}=0,01mol\\ \Rightarrow\dfrac{0,02}{1}< \dfrac{0,01}{2}\Rightarrow CaCl_2.dư\\ CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl\)
0,005 0,01 0,005 0,01
\(m_{AgCl}=0,01.143,5=1,435g\\ c)C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,005}{0,07}=\dfrac{1}{14}M\\ C_{M_{CaCl_2.dư}}=\dfrac{0,02-0,005}{0,07}=\dfrac{3}{14}M\)

\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Hiện tượng: Bột CuO tan trong dung dịch acid tạo thành dung dịch màu xanh lam.
Giải thích: Vì CuO là oxit base có tác dụng với acid tại thành dung dịch muối

Hiện tượng:
- Đinh sắt tan dần trong dd H2SO4 loãng và có chất khí không màu thoát ra.
- Chiếc đinh sắt bên ống nghiệm 1 tan nhanh hơn và p/ư xảy ra dữ dội hơn.
Nhận xét:
- Nhiệt độ cao làm tăng tốc độ phản ứng.
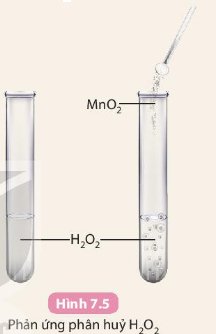
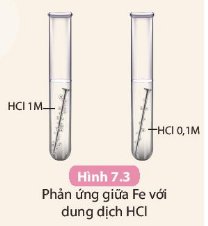

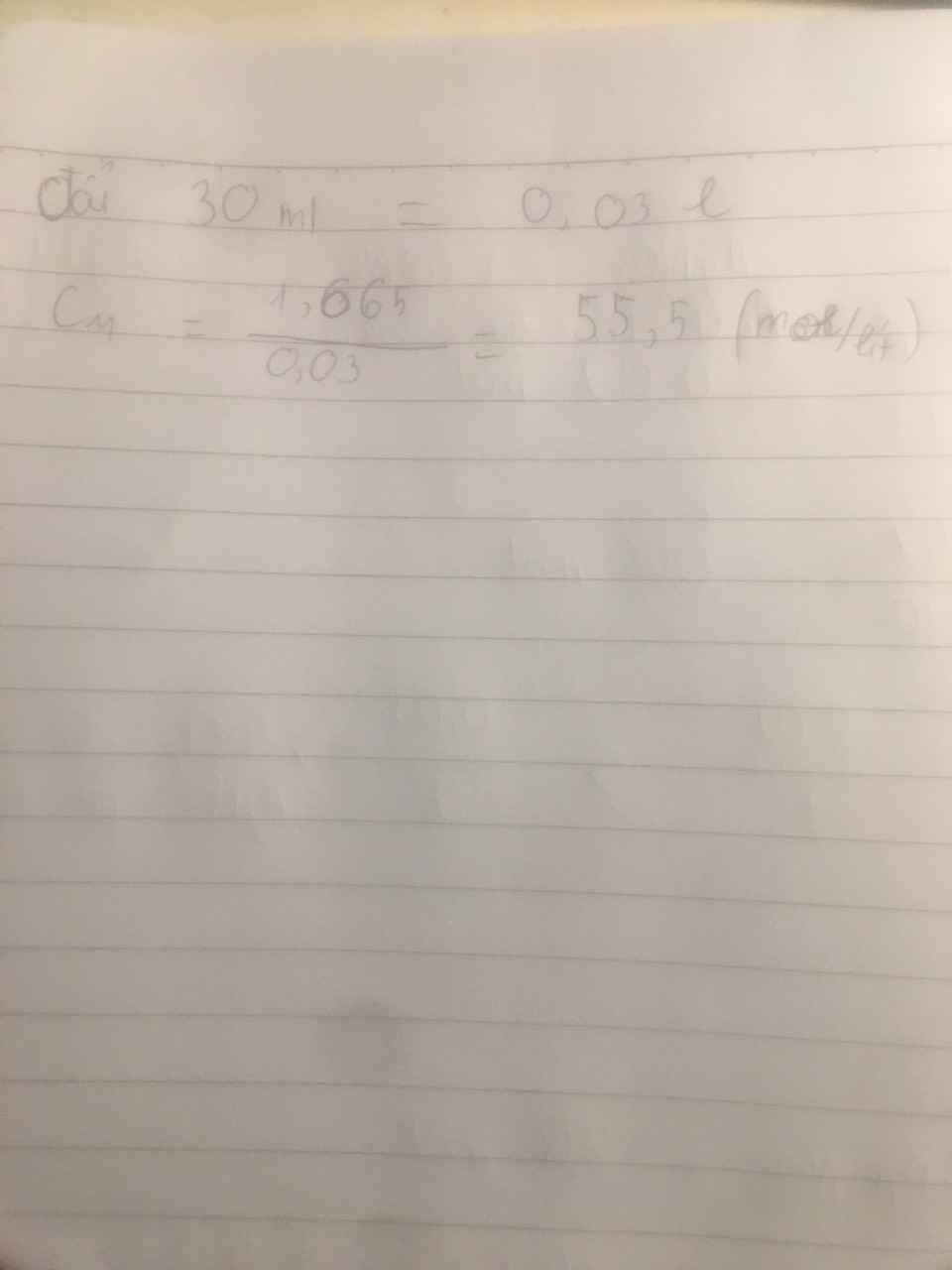
Phản ứng ở ống nghiệm (2) xảy ra nhanh hơn do khí thoát ra nhanh và mạnh hơn.
Phản ứng ở ống nghiệm (2) xảy ra nhanh hơn