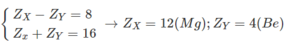Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nguyên tố Mg ở chu kì 3 nhóm IIA.
Nguyên tố Be ở chu kì 2 nhóm IIA.

Tổng điện tích hạt nhân là : 31
\(p_X+p_Y=31\left(1\right)\)
Hai nguyên tố nằm ở hai nhóm kế tiếp nhau cùng chu kì nên :
\(p_X-p_Y=1\left(2\right)\)
\(\left(1\right),\left(2\right):p_X=16,p_Y=15\)
Y: Ô 16 , Chu kì 3 , Nhóm VIA
X : Ô 15 , Chu kì 3 , Nhóm VA

NaX + AgNO 3 → NaNO 3 + AgX
a mol a mol a mol a mol
NaY + AgNO 3 → NaNO 3 + AgY
b mol b moi b mol b mol
n AgNO 3 = 0,2 x 150/1000 = 0,O3 mol
m AgNO 3 = 0,3 x 170 = 5,1g
n NaNO 3 = 0,O3 => m NaNO 3 = 0,03 x 85 = 2,55g
Áp dụng định luật bảo toàn khối lượng, ta có :
2,2 + 5,1 = 2,55 + m kết tủa → m kết tủa = 4,75 (gam)
(108 + X)a + (108 + Y)b = 4,75 ; a + b = 0,O3 (mol)
Xa + Yb + 15,1. Cho X > Y ; Xa + Xb > Xa + Yb > Ya + Yb
X > 1,51/0,03 > Y > X > 50,3 > Y
X và Y là các halogen liên tiếp, vậy đó là brom (80) và Cl (35,5).

a) Do tổng điện tích hạt nhân là 25
\(\rightarrow Z_X+Z_Y=25\left(1\right)\)
Do X và Y là 2 nguyên tố liên tiếp nhau
\(\rightarrow Z_X+1=Z_Y\)
\(\Leftrightarrow Z_X-Z_Y=-1\left(2\right)\)
Từ (1), (2) \(\rightarrow\left\{{}\begin{matrix}Z_X=12\\Z_Y=13\end{matrix}\right.\)
Vậy X là Magie (Mg) ; Y là Nhôm (Al)
b) Magie
- Ô nguyên tố thứ 12
- Chu kì 3
- Nhóm II A
Nhôm:
- Ô nguyên tố thứ 13
- Chu kì 3
-Nhóm III A

Hai nguyên tố kế tiếp nhau lại thuộc cùng một nhóm A thì nó sẽ cách nhau 8 nguyên tố tức là hơn kém nhau 8e. Mặt khác tổng số p = 24 tức là tổng số e = 24
Gọi số hạt e của nguyên tố X là x Số hạt e của nguyên tố Y là y
Ta có
x - y = 8
x + y = 24
Giải ra tìm đc x=8 và y=16
Số e = STT trong BTH nên X là O còn Y là S
Thuộc cùng nhóm VI A
X là O Y là S
-Tính Chất:
1. Oxi và lưu huỳnh là những nguyên tố phi kim có tính oxi hóa mạnh, trong đó oxi là chất oxi hóa mạnh hơn lưu huỳnh.
- Oxi oxi hóa hầu hết các kim loại (trừ Au, Pt, Ag), nhiều phi kim và nhiều hợp chất hóa học.
Thí dụ : 3Fe + 2O2 -.> Fe3O4
4P + 5O2 -> 2P2O5
C2H5OH + 3O2 -> 2CO2 + 3H2O
-Lưu huỳnh oxi hóa nhiều kim loại và hiđro ở nhiệt độ cao.
2Al + 3S -> Al2S3 ;
H2 + S -> H2S
S + O2 -> SO2.
2. Khác với oxi, lưu huỳnh còn thể hiện tính khử khi tác dụng với những chất có độ âm điện lớn hơn như O, F.

Gọi công thức chung của 2 kim loại là X
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: X + 2H2O --> X(OH)2 + H2
0,3<-------------------0,3
=> \(M_X=\dfrac{8,8}{0,3}=29,33\left(g/mol\right)\)
Mà 2 kim loại thuộc 2 chu kì liên tiếp nhóm IIA
=> 2 kim loại là Mg(Magie) và Ca(Canxi)

Bài 3 :
3,72g X + H2O ---> X2O + 1,344 l H2
.....................................................0,06
Các quá trình cho nhận e :
Xo - 1e -> X+1
.........x................
2H+1 - 2e -> H2o
...........0,12.....0,06
ne cho = ne nhận => x = 0,12 ( mol )
Ta có :
Mx = \(\dfrac{3,72}{0,12}=31\)
=> \(\left\{{}\begin{matrix}M1< 31\\M2>31\end{matrix}\right.\)
=> Đó là Na(23) và K(39)
Bài 1 :
X có hạt nhân mang đt 17+
=> Z+ = 17
Ta có X có 3 lớp e và 7 e lớp ngoài cùng
Cấu hình e : 1s22s22p63s23p5
X là Cl ( Clo )
Vị trí :
- Nằm ở ô thứ 17 trong bảng tuần hoàn
- Chu kì 3 , nhóm VIIA