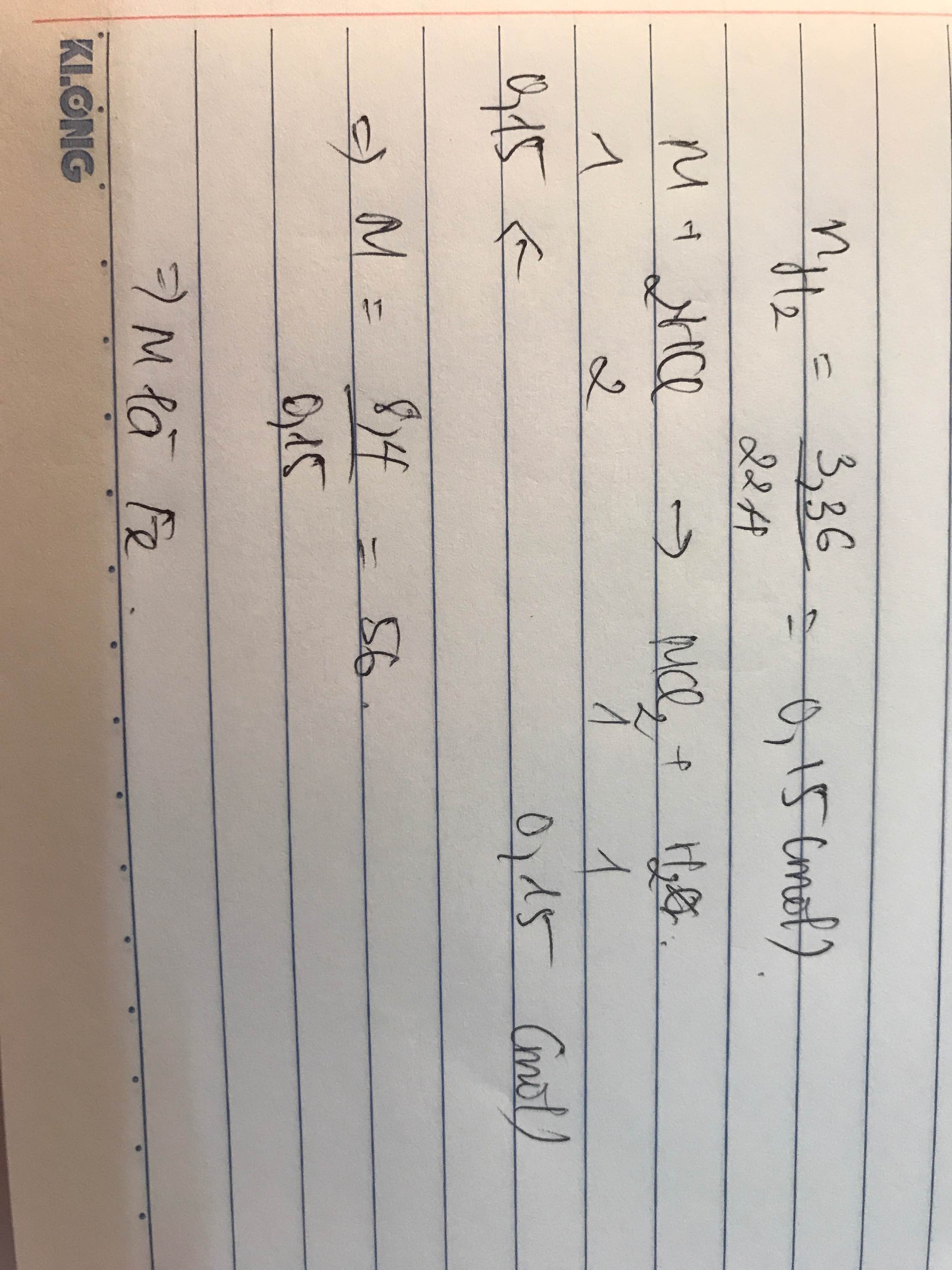Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{HCl}=0,2\cdot2=0,4\left(mol\right)=n_{NaOH}\)
\(\Rightarrow C_{M_{NaOH}}=\dfrac{0,4}{0,2}=2\left(M\right)\)
Câu 2: Bạn xem lại đề !!

a)
Gọi hóa trị hai kim loại là n
$4A + nO_2 \xrightarrow{t^o} 2A_2O_n$
$4B + nO_2 \xrightarrow{t^o} 2A_2O_n$
$A_2O_n + 2nHCl \to 2ACl_n + nH_2O$
$B_2O_n + 2nHCl \to 2BCl_n + nH_2O$
$ACl_n + nNaOH \to A(OH)_n + nNaCl$
$BCl_n + nNaOH \to B(OH)_n + nNaCl$
b)
Theo PTHH :
$n_{OH} = n_{NaOH} = n_{NaCl} = n_{HCl} = 0,15(mol)$
$m_{kết\ tủa} = m_{kim\ loại} + m_{OH} = 8 + 0,15.17 = 10,55(gam)$

* Phần tính toán:
Khối lượng dung dịch NaOH: m d d = D.V = 1,1.2000=2200(g)
Khối lượng NaOH có trong 2 lit dung dịch:
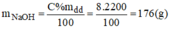
Gọi x(ml) là thể tích của dung dịch NaOH 3% ⇒ m d d = V.d = 1,05.x
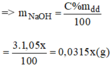
Gọi y(ml) là thể tích của dung dịch NaOH 10% ⇒ m d d = V.d = 1,12.y
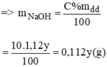
Ta có hệ phương trình sau: 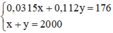
Giải hệ phương trình trên, ta được: 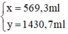
* Cách pha chế:
Đong lấy 569,3ml dung dịch NaOH 3% và 1430,7ml dung dịch NaOH 10% vào bình có dung dịch khoảng 3 lit. Trộn đều ta được 2 lit dung dịch NaOH 8% có khối lượng riêng 1,1g/ml.

Bài 2
Ta có:
nFe=0,2 mol nHCl=0,6 mol
Fe+2HCl=FeCl2+H2
0,2->0,4--->0,2
suy ra sau phản ứng có: 0,2molFeCl2 và 0,2mol HCl dư
CM muối=0,2/0,2=1M
CM axit dư=0,2/0,2=1M

Bài 1 :
Giả sử thể tích dung dịch H2SO4 là V ml
\(\rightarrow m_{dd}=1,84V\left(g\right)\rightarrow m_{H2SO4}=1,84V.98\%=1,8032\left(V\right)\)
\(\rightarrow n_{H2SO4}=\frac{1,8032V}{98}=0,0184V\left(mol\right)\)
\(\rightarrow CM_{H2SO4}=\frac{0,0184V.1000}{V}=18,4M\)
\(n_{H2SO4}=2.2,5=5\left(mol\right)\rightarrow m_{H2SO4}=5.98=490\left(g\right)\)
\(\rightarrow m_{dd_{H2SO4_{Can}}}=\frac{490}{98\%}=500\left(g\right)\)
Vậy V dung dịch H2SO4 cần \(=\frac{500}{1,84}=271,74\left(ml\right)\)
Cho 271,74 ml H2SO4 98% vào dung dịch, sau đó thêm H2O vào đủ 2 lít/
Bài 2:
Gọi số mol Na2O cần là x \(\rightarrow m_{Na2O}=62x\)
\(\rightarrow\) m dung dịch sau khi thêm=62x+84,5 gam
\(Na_2O+H_2O\rightarrow2NaOH\)
\(\rightarrow n_{NaOH_{tao.ra}}=2x\rightarrow m_{NaOH_{tao.ra}}=2x.40=80x\left(g\right)\)
\(\rightarrow\) m NaOH trong dung dịch \(=80x+84,5.10\%=80x+8,45\left(g\right)\)
\(\rightarrow C\%_{NaOH}=\frac{\left(80x+8,45\right)}{\left(62x+84,5\right)}=28,45\%\rightarrow x=0,25\)
\(\rightarrow m_{Na2O}=15,5\left(g\right)\)
Bài 3 :
\(n_{MgCO3}=\frac{16,8}{84}=0,2\left(mol\right)\)
\(n_{HCl}=\frac{200.10,95\%}{36,5}=0,6\left(mol\right)\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
Nên HCl dư
\(n_{CO2}=0,2\left(mol\right)\)
\(n_{HCl_{du}}=0,6-0,2.2=0,2\left(mol\right)\)
\(m_{dd_{Spu}}=16,8+200-0,2.44=208\left(g\right)\)
\(C\%_{HCl}=\frac{0,2.36,5}{208}.100\%=3,51\%\)
\(C\%_{MgCl2}=\frac{0,2.95}{208}.100\%=9,13\%\)

Đặt kim loại là \(M\), oxit là \(MO\).
Giả sử có \(1molMO\) phản ứng, \(1molH2SO4\) phản ứng:
\(MO+H2SO4\rightarrow MSO4+H_2O\)
\(C\%=\dfrac{mtc}{mdd}.100\%\)
\(10\%=\dfrac{1.90}{mdd}.100\%\)
\(\rightarrow mDd\) \(H2SO4=980g\)
Theo định luật bảo toàn khối lượng, ta có:
\(mdd=mMO+mddH2SO4=\left(M+16\right)+980=M+996\)
\(C\%\)muối \(=\dfrac{mctm}{mddm}.100\%\)
\(15.17\%=\dfrac{M+96}{M+996}.100\%\)
\(M=64,95g\)
\(MO+H_2SO_4--->MSO_4+H_2O\)
Gọi a là số mol của MO
\(=> mMO=(M+16)a \)\((g)\)
Theo PTHH \(nH_2SO_4=mMO=a(mol)\)
\(=>mH_2SO_4=98a(g)\)
\(=> mddH_2SO_4=\dfrac{98a.100}{20}=490a(g)\)
\(=> mdd sau =490a + (M+16)a\)
\(=(M+506).a\)\((g)\)
Theo PTHH \(nMSO_4=a(mol)\)
\(=> mMSO_4=(M+96).a\)\((g)\)
Theo đè, ta có: \(22,64=\dfrac{(M+96).a.100}{(M+506).a}\)
\(=>M=24\)
Kim loại M cần tìm là Mg