Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{NACl}=\frac{5,85}{58,5}=0,1\left(mol\right)\)
\(n_{AgNO_3}=\frac{34}{170}=0,2\left(mol\right)\)
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 (mol)
\(m_{AgCl}=143,5.0,1=14,35g\)
b) \(V_{dd}=300+200=500\left(ml\right)\)
\(C_M\left(NaNO_3\right)=C_M\left(AgNO_3\right)=\frac{0,1}{0,5}=0,2\left(M\right)\)
a)nNaCl=0,1 mol , nAgNO3=0,2 mol
NaCl+AgNO3---->AgCl+NaNO3
theo pt và theo bài ra: NaCl hết, AgNO3 dư 0,1 mol
=> nAgCl=nNaCl=0,1=>mAgCl=14,35 gam.
b) thể tích sau phản ứng=200+300=500 ml= 0,5 lít
Nồng độ CMAgNO3=CMNaNO3=0,1/0,5=0,2.

a) \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(n_{HCl}=\dfrac{146.5\%}{36,5}=0,2\left(mol\right)\)
PTHH: CuO + 2HCl --> CuCl2 + H2O
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,2}{2}\) => CuO hết, HCl dư
=> dd sau phản ứng chứa CuCl2, HCl dư
b)
PTHH: CuO + 2HCl --> CuCl2 + H2O
0,05-->0,1------>0,05
mdd sau pư = 4 + 146 = 150 (g)
\(\left\{{}\begin{matrix}C\%_{CuCl_2}=\dfrac{0,05.135}{150}.100\%=4,5\%\\C\%_{HCldư}=\dfrac{\left(0,2-0,1\right).36,5}{150}.100\%=2,433\%\end{matrix}\right.\)
b)
PTHH: NaOH + HCl --> NaCl + H2O
CuCl2 + 2NaOH --> 2NaCl + Cu(OH)2
0,05--------------------------->0,05
Cu(OH)2 --to--> CuO + H2O
0,05----------->0,05
=> \(a=m_{Cu\left(OH\right)_2}=0,05.98=4,9\left(g\right)\)
=> \(b=m_{CuO}=0,05.80=4\left(g\right)\)

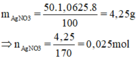
Phương trình hóa học của phản ứng:
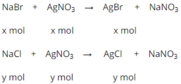
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dung dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
Gọi nNaBr = x, nNaCl = y.
Theo pt: nNaBr = nAgNO3; nNaCl = nAgNO3
⇒ nNaBr + nNaCl = nAgNO3
Ta có hệ phương trình đại số: 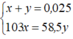
Giải ra, ta có x ≈ 0,009 mol
→ mNaBr = mNaCl = 103 x 0,009 = 0,927g
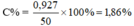

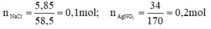
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 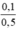 = 0,2 mol/l.
= 0,2 mol/l.
