Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.Trong các hiđrohalogenua, tính khử tăng theo thứ tự sau:
a) HF<HCl<HBr<HI
b) HCL<HI<HBR<HF
c) HF<HBR<HCL<HI
d) HI< HBr<HCL<HF
2) A
Do nguyên tử I có bán kính lớn nhất trong các halogen nên liên kết H-I là dài nhất trong các liên kết H-X của hidro halogenua \(\rightarrow\) Liên kết dễ bị phá vỡ nhất vì vùng xen phủ ở xa hạt nhân nhất\(\rightarrow\) H trong HI dễ dàng bị tách ra tạo ion H+. Vậy HI có tính axit mạnh nhất.
3) D
Trong nhóm halogen, flo có độ âm điện lớn nhất nên dễ dàng hút e về phía mình tạo ion F-. Vậy F2 có tính oxh lớn nhất.

a) ở cùng một nhiệt độ, cặp chất Fe + dd HCL 0,1M có tốc độ phản ứng xảy ra chậm hơn so với cặp chất Fe + dd HCL 2M, do nồng độ HCL nhỏ hơn.
b) Hai cặp chất AI + dd NaOH 2M ở 25 °C và Al + dd NaOH 2M ở 50 °C chỉ khác nhau về nhiệt độ. Cặp chất thứ hai có nhiệt độ cao hơn nên có tốc độ phản ứng cao hơn.
c) Hai cặp chất Zn (hạt) + dd HCl 1M ở 25 °C và Zn (bột) + dd HCL 1M ở 25°C chỉ khác nhau về kích thước hạt. Cặp chất thứ hai có kích thước hạt nhỏ hơn, do đó có tổng diện tích bề mặt lớn hơn và tốc độ phản ứng cao hơn.
d) Nhiệt phân KClO3KClO3 và nhiệt phân hỗn hợp KClO3KClO3 với MnO2MnO2. Trường hợp thứ hai có xúc tác nên có tốc độ phản ứng cao hơn.
Các yếu tố ảnh hưởng đến tốc độ phản ứng:
- NỒNG ĐỘ : nồng độ chất tham gia lớn thì pứ diễn ra nhanh hơn.
- NHIỆT ĐỘ : khi tăng nhiệt độ thì pứ diễn ra nhanh hơn.
- ÁP SUẤT : đối với các pứ có sự tham gia của chất khí, khi tăng áp suất thì tốc độ pứ diễn ra nhanh hơn.
- DIỆN TÍCH TIẾP XÚC : khi chất tham gia là chất rắn, hạt càng nhỏ thì tốc độ phản ứng diễn ra càng nhanh.
- CHẤT XÚC TÁC : trong một số phản ứng thì chất xúc tác khiến phản ứng diễn ra nhanh hơn.

PTHH của phản ứng điều chế khí oxi :
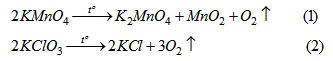
Nếu các chất có cùng khối lượng :
Theo (1) : 316 g KMnO4KMnO4 điều chế được 1 mol O2O2.
Theo (2) : 245 g KClO3KClO3 điểu chế được 3 mol O2O2.
Vậy 316 g KClO3KClO3 điều chế được : 3.316245≈3,87(mol)O23.316245≈3,87(mol)O2.
Kết luận : Nếu dùng cùng một khối lượng thì thể tích khí oxi thu được từ KClO3KClO3 nhiều hơn 3,87 lần so với KMnO4KMnO4.
b) Nếu các chất có cùng số mol :
Theo (1): 2 mol KMnO4KMnO4 điều chế được 1 mol khí O2O2.
Theo (2) : 2 mol KClO3KClO3 điều chế được 3 moi khí O2O2.
Kết luận : Nếu dùng cùng số mol thì thể tích khí oxi thu được từ KClO3KClO3 nhiều hơn 3 lần so với KMnO4KMnO4.

a)
- Trích mỗi lọ một ít để làm mẫu thử, cho vào ống nghiệm, đánh số thứ tự lần lượt ở các ống nghiệm.
- Dùng giấy quỳ tím cho lần lượt vào các mẫu thử, ta được:
+ Hai mẫu thử làm giấy quỳ tím chuyển sang màu đỏ là HCl và HNO3.
+ Mẫu thử làm giấy quỳ chuyển sang màu xanh là NaOH (phân biệt được NaOH).
- Cho một ít dung dịch AgNO3 (Bạc nitrat) vào trong hai mẫu thử chưa phân biệt được còn lại, ta được:
+ Ống nghiệm nếu chứa mẫu thử HCl sẽ có hiện tượng kết tủa trắng, đó chính là kết tủa AgCl. (Phân biệt được HCl)
PTHH: \(HCl+AgNO_3\rightarrow AgCl\downarrow+HNO_3\)
+ Ống nghiệm nếu chứa mẫu thử HNO3 sẽ không có hiện tượng gì xảy ra.
b)
- Trích mỗi chất một ít để làm mẫu thử, cho lần lượt các mẫu thử vào 4 ống nghiệm khác nhau được đánh số thứ tự để tránh bị nhầm lẫn.
- Cho giấy quỳ lần lượt vào các ống nghiệm có đựng các mẫu thử, ta được:
+ Nếu ống nghiệm chứa mẫu thử NaOH sẽ làm giấy quỳ chuyển sang màu xanh. (Phân biệt được NaOH)
+ Nếu ống nghiệm chứa mẫu thử H2SO4 sẽ làm giấy quỳ chuyển sang màu đỏ. (Phân biệt được H2SO4)
+ Nếu có hai ống nghiệm chức 2 mẫu thử lần lượt là NaNO3 và NaCl thì giấy quỳ không đổi màu.
- Cho một ít dung dịch AgNO3 vào 2 ống nghiệm chứa 2 mẫu thử chưa được phân biệt còn lại, ta được:
+ Nếu ống nghiệm của mẫu thử nào có xuất hiện kết tuả màu trắng thì đó là mẫu thử NaCl. (Phân biệt được NaCl)
PTHH: \(NaCl+AgNO _3\rightarrow NaNO_3+AgCl\downarrow\)
+ Nếu ống nghiệm của mẫu thử nào không có hiện tượng gì xảy ra, đó chính là ống nghiệm chứa mẫu thử của NaNO3.

Các yếu tố ảnh hưởng đến tốc độ phản ứng trong mỗi trường hợp đã cho là :
a) Tăng nồng độ chất tham gia phản ứng (khí oxi) làm tăng tốc độ phản ứng.
b) Giảm nồng độ chất tham gia phản ứng (khí oxi) làm giảm tốc độ phản ứng.
c) V2O5V2O5 là chất xúc tác, làm tăng tốc độ phản ứng.
d) Giảm kích thước hạt để tăng tốc độ phản ứng.
1. Dãy các nguyên tố nào sau đây đc xếp theo chiều bán kính nguyên tử tăng dần là
A. Li < Na< AL< P< Cl
B. F< N< Si < AL < K
C. O < C < Mg< K < Ca
D. F < Cl< Si < P < Na
2. Dãy các nguyên tố nào sau đây KHÔNG đc xếp theo thứ tự giảm dần bán kính nguyên tử:
A. K > Ca> Mg > Al
B. K > Na > Si > S
C. Sr > AL > P > Cl
D. Na> AL > O > N
3. Cho các nguyên tố A ( Z =11) ; B ( Z =8) ; C ( Z =15) , D( Z =19). Bán kính nguyên tử của các nguyên tố tăng dần theo thứ tự
A. A< B < C < D
B. D< C< B < A
C. B< A < C < D
D. B < C <A< D