Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CT oxit của kim loại R (III): R2O3
%O = 30% => %R = 70%
Theo đề bài ta có:
\(\frac{2R}{3O}=\frac{2R}{3.16}=\frac{70}{30}\)
==> R = 56 (Fe)
CT: Fe2O3
CT oxit của kim loại R (III): R2O3
%O = 30% => %R = 70%
Theo đề bài ta có:
2R/3O=2R/3.16=70/30
==> R = 56 (Fe)
CT: Fe2O3

Nếu ko ai làm thì tớ làm
Công thức dạng chung : Y2On
Ta có :
%O = \(\frac{16.n}{M\left(hh\right)}.100=31,58\%\) (1)
%Y = 100% - 31,58% = 68,42% (2)
Từ 1 và 2
=> Mh/c = \(\frac{16n}{31,58}=\frac{2Y}{68,42}\)
=> 63,16 . Y = 1094,72 . n
=> y = \(\frac{1094,72}{63,16}.n=17,33.n\)
Ta có bảng sau :
| n | 1 | 2 | 3 | 4 | 8/3 |
| MY | 17,3 | 34,66 | 51,99 | 69,33 | 46,22 |
=> Y là Crom(Cr) = 52 đvC
Nếu ko ai trả lời thì tớ trả lời z !
Công thức dạng chung : Y2On
Ta có :
%O = \(\frac{16n}{M_{hc}}.100=31,58\) (1)
%Y = 100% - 31,58% = 68,42% (2)
Từ 1 và 2
=> Mh/c = \(\frac{16n}{31,58}=\frac{2Y}{68,42}\)
=> 63,16 . Y = 1094,72 . n
=> Y = \(\frac{1094,72}{63,16}.n=17,33n\)
Ta có bảng sau
| n | 1 | 2 | 3 | 4 | 8/3 |
| MY | 17,3 | 34,66 | 51,99 | 69,33 | 46,22 |
Vậy Y là Crom(Cr)

Đặt công thức của oxit kim loại là MxOy
%mO = 100% - 70% = 30%
⇒ mO = 12y = 160.30% = 48
⇒ y = 3
mM = 160.70% = 112g = M.x (với M là phân tử khối của kim loại M)
Áp dụng quy tắc hóa trị ta có:
a.x = 2.3 = 6 (với a là hóa trị của M; a = 1; 2; 3)
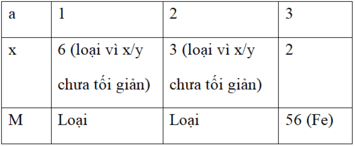
⇒ M là kim loại Sắt.
Vậy công thức hóa học của oxit kim loại là Fe2O3 (Sắt (III) oxit).

H2O: oxit trung tính (hình như thế): nước: nước: ko có tương ứng
Al2O3: oxit lưỡng tính: nhôm oxit: Al(OH)3
CO2: oxit axit: cacbon đioxit: H2CO3
FeO: oxit bazơ: sắt (II) oxit: Fe(OH)2
SO3: oxit axit: lưu huỳnh trioxit: H2SO4
P2O5: oxit axit: điphotpho pentaoxit: H3PO4
BaO: oxit bazơ: bari oxit: Ba(OH)2
b) %O = 100% - 71,429% = 28,571%
M(RO) = 16/28,571% = 56 (g/mol)
=> R + 16 = 56
=> R = 40
=> R là Ca

Thực ra mik có giải rồi nhưng vẫn muốn đăng lên để m.n nhận xét. Mik có sai đề 50,48% nhé m.n :
Gọi công thức oxit kim loại với hoá trị thấp :M2Oy
Ta có %mO = 22,56%
=> %mM = 77,44
<=> 2M / (2M+16y) = 77,44%
<=> 2M + 16y = 2,58M
<=> 0,58M = 16y
<=> M = 27,5y(1)
Gọi công thức oxit kim loại với hoá trị cao: M2Oy'
Ta có: %mO = 50,48%
=> %mM = 49,53%
<=> 2M / (2M+16y') = 49,53%
<=> 2M+16y' = 4,04M
<=> M = 7,85y' (2)
Lấy (2) chia (1) ta có:
y' / y = 3.5
<=> y' = 3,5y
Vì y'≤7 => y≤2
y =1 => y'=3.5 (loại)
y= 2 => y'=7 (thoả mãn)
=> M =55
Vậy kim loại đó là Mangan và 2 công thức oxit thấp nhất và cao nhất tương ứng là: :MnO và Mn2O7.

cho công thức là XO
m XO=\(\dfrac{16.100}{40}\)=40g
=>%X=100-40=60%
MX=\(\dfrac{40.60}{100}\)=24g\mol
=>X là Mg(Magie)

Cái đề hình như sai sửa lại xíu :Cho biết khối lượng mol một oxit kim loại là 160g. thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxít đó. (Nếu đề không sai thì kq không đẹp)
Đặt CTHH của oxit là : \(M_xO_y\).
Theo bài ra ta có ;
\(M_M=160\dfrac{g}{mol}\)
mO=160.30%=48(g)-> nO= 3mol
\(\Rightarrow\) số nguyên tử tử oxi trong oxit kim loại là 3 nguyên tử oxi.
Vậy công thức hoá của oxit là \(M_2O_3.\)
mà \(m_A=\dfrac{160.70}{100}=112g\)
M = \(\dfrac{112}{x}\)
x = 1 => M = 112 (loại)
x = 2 => M = 56 (nhận)
x = 3 => M = 37,3 (loại)
\(\rightarrow M_A=\dfrac{112}{2}=56g\)
Vậy kim loại đó là Fe .
\(\Rightarrow CTHH:Fe_2O_3\)
Gọi tên : Sắt (III) oxit .
Gọi công thức của oxit đó là MxOy
Ta có Mx/(Mx + 16y) = 70/100
Mà Mx + 16y = 160 => Mx = (70/100).160 = 112g => M = 112/x
Với x = 2 => M = 56 (Fe)
x = 2 => y = (160 - 56.2)/16 = 3
Vậy oxit kim loại có công thức là Fe2O3 (Sắt (III) oxit)
* Nói thêm một chút tại sao x = 2 : cái này do mình làm tắt đó thôi, chứ đúng ra phải biện luận thế này nè :
M = 112/x
x = 1 => M = 112 (loại)
x = 2 => M = 56 (Fe)
x = 3 => M = 37,3 (loại)
CTDC : \(A_2O_n\)
Theo bài ra ta có
\(\frac{2A}{2A+16n}.100\%=30\%\)
=>\(\frac{16n}{2A+16n}=0,3\)
=>16n = 0,6A +4,8n
=> 0,6A=11,2n
Ta có
37,3
Vậy A là Fe
CTHH; Fe2O3
Nhớ tích cho mk nhé
\(CTPT:A_2O_n\)
Theo đề:
\(\Rightarrow\frac{2A}{16n}=\frac{70}{30}\\ \Leftrightarrow A=18,\left(6\right)n\\ BL:n=1\rightarrow A=19\\ n=2\rightarrow A=37\\ n=3\rightarrow A=56\left(Fe\right)\\ \rightarrow A:Fe\left(Sat\right)\)