Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Theo giả thiết ta thấy ban đầu H 2 = N 2 = 1 M .
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng NH 3 = 0 , 4 M
Phương trình phản ứng hoá học :

Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] =0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :
K C = NH 3 2 N 2 H 2 3 = ( 0 , 4 ) 2 0 , 8. ( 0 , 4 ) 3 = 3 , 125

CM(I2)=0.02M
gọi nồng độ iot chuyển hóa là x
I2(k) <=> 2I(k)
pư: x 2x
cb: 0.02-x 2x
Ta có: (2x)^2/ 0.02-x = 3,80*10^-5
=> x=4,311*10^-4
=> [I2] = 0.02-4,311*10^-4=0,019M
=>[I] = 9,5*10^-3(M)

Đáp án B
Theo gải thiết ban đầu ta thấy [H2]=[N2]=1M
Thực hiện phản ứng tổng hợp NH3đến thời điểm cân bằng [NH3] = 0,4 m
Ta có: N2+3H2 ⇌2NH3
Bdau: 1………1………….0
p.ung:0,2…….0,6……….0,4
Sau: 0,8………0,4……….0,4
Tại thời điểm cân bằng [N2]=0,8;[H2]=0,4M;[NH3]=0,4M
→Kc = 3,125

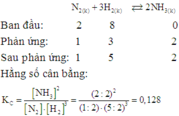
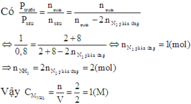
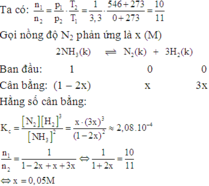
............ ....... C... + ..CO2 <=> 2CO
Ban đầu:.. 0,2 mol......1
p.ư:............a mol.........a..............2a
Lúc cân =:0,2-a.........1-a.............2a
Kc=[CO]^2/[CO2] =(2a/22,4)^2 / [(1-a)/22,4) =0,002
Giải ra ta có a=0,1
=>Ở trạng thái cân bằng:
nCO=2.0,1=0,2 mol
nCO2=1-0,1=0,9 mol
nC=0,2-0,1=0,1 mol