Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

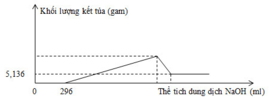
Chọn C
Vì: Quan sát đồ thị ta thấy:
mFe(OH)3 = 5,236 gam => nFe(OH)3 = 0,048 mol
nHNO3 dư = 0,296 mol => nHNO3 pư = 0,8 – 0,296 = 0,504 mol
Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng
BT e: 3nAl = 2nSO2 => nAl = 2.0,09/3 = 0,06 mol
Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
0,06→0,24
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,024←0,144←0,048
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,02 ←0,504-0,24-0,144 = 0,12
mCr2O3 (1 phần) = 0,02.152 = 3,04 gam
=> mCr2O3 = 6,08 gam

Sau phản ứng có Al dư do phản ứng với NaOH tạo H2
=> nAl dư = 2/3 .nH2 = 0,02 mol
Sau phản ứng có Al và Al2O3 + NaOH => NaAlO2
Bảo toàn Al ta có :
2nAl2O3 sau nung= nAl dư + 2nAl2O3 => nAl2O3 = 0,04 mol
=>nAl ban đầu = 0,1 mol
Do các phản ứng hàn toàn , mà khi nhiệt nhôm Al dư => oxit sắt hết
=>D chỉ có Fe
=>Bảo toàn e : 3nFe = 2nSO2 => nFe = 0,08 mol
Bảo toàn khối lượng : mA = mB = mFe + mAl + mAl2O3 = 9,1g
=>%mAl(A) = 29,67% gần nhất với giá trị 24%
=>A

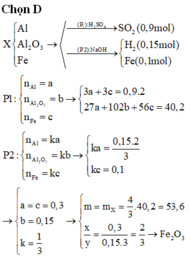


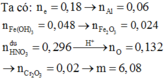


Đáp án C
Phản ứng hoàn toàn thu được
sản phẩm + KOH ⇒ H2 ⇒ Al dư.
Ta có phản ứng:
8Al + 3Fe3O4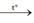 4Al2O3 + 9Fe.
4Al2O3 + 9Fe.
Với nAl dư = 2nH2÷3 = 0,02 mol.
Xem hỗn hợp X gồm: nAl = 0,02
nAl2O3 = a || nFe = b ta có:
PT bảo toàn e với SO2:
3nAl + 3nFe = 2nSO2
Û nFe = b = 0,0225
⇒ nAl2O3 =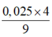 = 0,01.
= 0,01.
Bảo toàn khối lượng
mHỗn hợp ban đầu = mAl + mAl2O3 + mFe
= 2,82 gam.
Bảo toàn nguyên tố Al
⇒ ∑nAl ban đầu = 0,02 + 0,01×2 = 0,04 mol.
⇒ %mAl =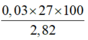
= 38,298%